Контроль температурного режима хранения вакцин в холодильнике осуществляется
Обновлено: 15.05.2024
экстремумов, то эффективность вакцины может быть потеряна.
Подавляющее большинство вакцин должно храниться в холодильнике при температуре от 2 до 8 °С, предпочтительное среднее значение – 5 °С с
минимальными колебаниями. Для этой цели обычно используются специально разработанные лабораторные холодильники, которые имеют сравнительно
минимальные колебания температуры в течение нескольких дней и сезонов, не представляют никаких экстремумов температуры на любой внутренней
поверхности и могут иметь внешний температурный дисплей, который автоматически регистрирует внутреннюю температуру в определенные промежутки времени.
Многие живые вакцины переносят замораживание, и в зависимости от конкретных инструкций производителя вместо этого замораживаются при температуре
от -15 до -50 °C. Среди обычно вводимых вакцин это включает только ветряную оспу и опоясывающий лишай, причем большинство других вакцин не охлаждаются.
Большинство невоспроизводящихся вакцин: инактивированные вирусы или бактерии, очищенные белковые субъединицы, углеводные антигены и рекомбинантные
субъединицы белковых антигенов вводятся вместе с адъювантами, такими как соли алюминия. Соли алюминия используются в вакцинах по всему миру уже почти
столетие, действуя для образования ионной связи с антигеном, представляющим интерес для вакцины, значительно улучшая стабильность и эффективность.
В более поздние годы была обнаружена дополнительная потенциально чрезвычайно важная цель в использовании адъювантов соли алюминия, поскольку они,
по-видимому, помогают стимулировать усиленный иммунный ответ хозяина после введения вместе с вакциной. Соли алюминия действуют на моноциты, макрофаги
и гранулоциты, индуцируя цитокины, создавая местную иммуностимулирующую среду. Они также могут вызывать местный некроз стромальных клеток, вызывая
высвобождение мочевой кислоты, которая затем активирует инфламмасомы.
В любом случае соли алюминия очень чувствительны к повреждению при замораживании, так как циклы замораживания-оттаивания вызывают агрегацию и
осаждение коллоидных частиц. Высокие температуры практически не влияют на структуру алюминиевого геля.
Действительно, повреждения от замораживания часто гораздо более эффективны, чем повреждения, связанные с нагревом, для вакцин, хотя большинство производителей
рекомендуют не позволять им находиться при комнатной температуре более тридцати минут, за исключением некоторых особых случаев. При экстремальных температурах,
приближающихся и превышающих 45 °С, белки, присутствующие в вакцине, относительно быстро денатурируются, в конечном счете полностью теряя свою эффективность,
поскольку структура антигена больше не присутствует.
Кумар и др. (1982) обнаружили, что вакцина против столбняка может выживать при температуре 35 °С в течение нескольких недель, в то время как при температуре
45 °С она испытывает потерю эффективности на 5% в день в течение первых двух недель хранения. При воздействии температуры 60 °C вакцина оказывалась полностью
неэффективной через три-пять часов. И наоборот, при хранении при температуре 30 °С в течение двенадцати часов противостолбнячная вакцина теряла около 30% своей
Белки, присутствующие в вакцине, могут быть непосредственно повреждены циклами замораживания-оттаивания несколькими механизмами.
Во время быстрого замораживания образуются мелкие кристаллики льда, которые обязательно представляют большую площадь поверхности для белков и поэтому
с большей вероятностью вступают в контакт, вызывая повреждение и частичное раскрытие.
Более крупные кристаллы льда наносят более серьезные повреждения, поглощая белки и потенциально повреждая контейнер с вакциной. При оттаивании процесс
рекристаллизации оказывает на белки напряжение сдвига.
Хранение вакцин при низких температурах также уменьшает потребность в других консервантах и снижает риск бактериального роста внутри вакцины. В вакцине
могут присутствовать различные другие химические вещества, такие как следы антибиотиков в процессе производства, стабилизаторы, такие как сорбит, и регуляторы
кислотности, такие как гистидин, все из которых, в свою очередь, могут подвергаться воздействию экстремальных температур.
1.1. Настоящие санитарно-эпидемиологические правила (далее - санитарные правила) устанавливают основные требования к транспортированию, хранению, отпуску аптечными учреждениями и учреждениями здравоохранения медицинских иммунобиологических препаратов (далее - МИБП), используемых для иммунопрофилактики инфекционных болезней; применению МИБП в лечебно-профилактических учреждениях; организации уничтожения МИБП в случае невозможности их использования.
1.2. Санитарно-эпидемиологические правила предназначены для граждан, индивидуальных предпринимателей, юридических лиц.
1.3. Контроль за выполнением настоящих правил проводят органы, осуществляющие государственный санитарно-эпидемиологический надзор.
2.3. Отечественные МИБП, поступающие в аптечные организации и организации здравоохранения, должны сопровождаться следующими документами:
• копия лицензии на право производства и реализации МИБП или лицензии на фармацевтическую деятельность;
• копия сертификата производства на реализуемый препарат, установленного образца (за исключением станций переливания крови);
• паспорт отделения биологического и технологического контроля (ОБТК) организации-изготовителя на реализуемую серию препарата.
2.4. Зарубежные МИБП, поступающие в аптечные организации и организации здравоохранения, должны сопровождаться следующими документами:
• копия лицензии на фармацевтическую деятельность;
• копия регистрационного удостоверения установленного образца на препарат;
• копия сертификата соответствия на реализуемую серию препарата.
3.2. Каждая партия МИБП должна иметь термоиндикатор.
3.3. Разгрузка МИБП проводится в максимально сжатые сроки (5 - 10 мин).
3.4. При разгрузке МИБП ответственное должностное лицо фиксирует в журнале учета поступления и расхода МИБП (прилож. 1) дату поступления, наименование препарата, его количество, серию, срок годности, фирму-производителя, условия транспортирования, показания термоиндикатора. Кроме того, он проводит выборочный визуальный осмотр поступившей партии препарата.
4.1. Для хранения МИБП могут использоваться помещения, предназначенные для термолабильных лекарственных средств. Площадь помещения определяется в соответствии с габаритами используемого оборудования.
4.2. В помещении предусматривается отопление (температура воздуха -18 °С), вентиляция (кратность воздухообмена при механической вентиляции: приток - 2, вытяжка - 3, при естественном воздухообмене - 1), водоснабжение (подводка воды с установкой раковины).
4.3. Допустимая освещенность рабочих поверхностей не менее 150 ЛК. Источник света - люминесцентные лампы или лампы накаливания.
4.4. Стены и пол должны быть покрыты материалами, выдерживающими влажную уборку и дезинфекцию.
4.5. Помещение оборудуется холодильниками с морозильными отсеками, рабочим столом, термоконтейнерами достаточной емкости, хладоэлементами, контейнером для мусора, емкостью для приготовления дезинфицирующего раствора.
4.6. В организациях здравоохранения, в частности в амбулаторно-поли-клинических учреждениях, для хранения МИБП может использоваться помещение прививочного кабинета, а также и другие помещения при соблюдении условий, изложенных в пунктах 4.1 - 4.5.
4.7. Хранение иммунобиологических препаратов осуществляется в холодильниках, оборудованных термометрами, при температуре (5±3) °С (в пределах от 2 до 8 °С), медицинские иммунобиологические препараты хранятся в промышленной упаковке и располагаются таким образом, чтобы к каждой упаковке был обеспечен доступ охлажденного воздуха, а препараты одного наименования хранятся по сериям, с учетом срока годности.
4.8. При больших объемах поставок для каждого вида МИБП выделяется отдельный холодильник. В случае небольшого объема поступлений возможно хранение вакцин в одном холодильнике на разных маркированных полках. Растворитель для вакцины хранится также в холодильниках.
4.9. В морозильной камере холодильника хранится необходимый запас хла-доэлементов.
4.10. Не допускается хранение МИБП на дверной панели холодильника.
4.11. Контроль за температурным режимом хранения вакцин осуществляется 2 раза в день. Показания термометра заносятся должностным лицом в журнал регистрации температурного режима холодильника (прилож. 2).
4.12. Медицинские иммунобиологические препараты следует в процессе хранения подвергать выборочному визуальному контролю не реже чем один раз в месяц.
4.13. При аварийном или плановом (на мойку) отключении холодильника вакцины хранятся в термоконтейнерах с хладоэлементами.
4.14. Факты аварийного или планового отключения холодильника фиксируются в журнале регистрации температурного режима холодильника.
4.16. Хранение в холодильнике иных предметов или лекарственных препаратов не допускается.
4.17. Транспортирование и хранение растворимых вакцин может осуществляться при температуре, превышающей 8 °С в случае, если это допускается соответствующими нормативными документами. Если растворители упакованы вместе с вакциной, их транспортирование и хранение осуществляют при температуре (5±3) °С (в пределах от 2 до 8 °С).
5.1. Аптечные учреждения, осуществляющие отпуск МИБП гражданам, ведут учет поступления и расхода МИБП. Для этого должны быть в наличии следующие документы:
• журнал учета поступления и расхода МИБП;
• накладные на приобретение МИБП;
• инструкции по применению МИБП на русском языке;
• акты об уничтожении МИБП;
• акты проверки условий хранения, учета и расходования МИБП специалистами центров Госсанэпиднадзора.
6.1. МИБП отпускаются гражданам по рецепту врача лечебно-профилактического учреждения (независимо от форм собственности и ведомственной принадлежности).
6.3. Гражданам выдается необходимое количество доз вакцины в соответствии с рецептом, вакцина снабжается инструкцией по применению на русском языке. На упаковке проставляется дата и время отпуска препарата.
6.4. Работник аптеки объясняет покупателю необходимость доставки препарата в лечебно-профилактическое учреждение в минимальные сроки (не более 48 ч) после приобретения препарата в условиях хранения последнего в термоконтейнере или холодильнике.
6.5. Приобретенная в аптечном учреждении вакцина используется в прививочных кабинетах ЛПУ, детских дошкольных образовательных учреждениях, медицинских кабинетах общеобразовательных учебных учреждений (специальных образовательных учреждениях), здравпунктах и других медицинских учреждениях, независимо от форм собственности, имеющих лицензию на проведение иммунопрофилактики при строгом соблюдении условий хранения и транспортирования.
7.1. МИБП подлежат уничтожению:
• с истекшим сроком годности;
• с изменившимися внешними свойствами, не обозначенными в инструкции (наличие хлопьев, инородных предметов, изменение цветности и прозрачности и др.).
7.2. Уничтожение МИБП проводится в том же помещении, где они хранятся.
7.3. Ампулы и флаконы с инактивированными и рекомбинантными вакцинами, иммуноглобулинами, гетерологическими сыворотками, живой коревой, па-ротитной и краснушной вакцинами вскрываются, содержимое выливается в раковину, стекло выбрасывается в емкость для мусора без дополнительного обеззараживания.
7.4. Ампулы и флаконы с другими живыми вакцинами после вскрытия помещают в 3 %-ный раствор хлорамина на 1 ч (вакцины БЦЖ и БЦЖ-М - в 5 %-ный раствор или 3 %-ный раствор перекиси водорода), затем выливают в раковину, стекло выбрасывают в емкость для мусора.
7.5. Для обеззараживания живых вакцин и загрязненных ими поверхностей используются дезинфекционные средства в соответствии с инструкцией по применению.
8.1. В случае повреждения емкости, содержащей вакцинный препарат (стеклянные флаконы, ампулы и пр.), ее уничтожают в соответствии с пунктами 7.3 - 7.5 настоящих правил.
8.2. При попадании вакцинного материала на слизистые оболочки глаз их промывают большим количеством воды.
8.3. В случае повреждения кожных покровов рану обрабатывают настойкой йода.
8.4. Мебель или участки пола, загрязненные вакцинным препаратом, обрабатываются 3 %-ным раствором хлорамина или другими дезинфектантами в соответствии с инструкцией по применению.
8.5. При уборке осколков стекла необходимо пользоваться щетками, пинцетом и совком.
1. Анатоксины - обезвреженные бактерийные экзотоксины, сорбированные на различных минеральных адсорбентах, предназначенных для иммунопрофилактики инфекционных заболеваний. Выпускаются в виде моно- и ассоциированных препаратов.
3. Вакцины - препараты, получаемые из бактерий, вирусов и продуктов их жизнедеятельности, предназначенные для иммунопрофилактики инфекционных заболеваний. Вакцины, содержащие один компонент, называются моновакцинами, в отличие от ассоциированных вакцин, содержащих несколько компонентов. Кроме того, вакцины разделяют на две основные группы: живые (например: вакцина против кори, краснухи, эпидемического паротита) и инактивированные (например: вакцина против дифтерии, коклюша, столбняка [АКДС]). В последние годы появились вакцины, полученные с помощью технологии рекомбинантной ДНК (вакцина против гепатита В).
4. Медицинские иммунобиологические препараты (МИБП) - лекарственные средства, предназначенные для иммунопрофилактики, иммунотерапии и диагностики инфекционных и неинфекционных болезней и аллергических состояний. Препараты, используемые для иммунопрофилактики, - вакцины, анатоксины, иммуноглобулины.
5. Регистрационный номер - кодовое обозначение, присвоенное лекарственному средству при государственной регистрации.
7. Термоконтейнер - емкость из термоизолирующего материала (полистирола или полиуретана) различных размеров с плотно закрывающейся крышкой из того же материала. Температура в термоконтейнерах, которая достигается благодаря помещению в его полость хладоэлементов, должна сохраняться в течение минимум 48 ч в пределах от 0 до 8 °С при температуре внешней среды 43 °С.
8. Хладоэлемент - пластмассовая емкость прямоугольной формы с герметически закрывающейся пробкой, заполняющаяся водой или специальной жидкостью и замораживающаяся в течение суток. Хладоэлемент, помещенный в термоконтейнер, создает в нем определенную температуру. Хладоэлементы бывают объемом от 0,3 до 0,6 л.
4. Положение о государственной санитарно-эпидемиологической службе Российской Федерации и Положение о государственном санитарно-эпидемиологическом нормировании, утвержденные постановлением Правительства Российской Федерации от 24.07.00 № 554.
9. Сертификация медицинских иммунобиологических препаратов: МУ 3.3.2.684-98.
10. Письмо Департамента государственного контроля качества, эффективности, безопасности лекарственных средств и медицинской техники Минздрава России от 02.03.99 № 293-22/8.
экстремумов, то эффективность вакцины может быть потеряна.
Подавляющее большинство вакцин должно храниться в холодильнике при температуре от 2 до 8 °С, предпочтительное среднее значение – 5 °С с
минимальными колебаниями. Для этой цели обычно используются специально разработанные лабораторные холодильники, которые имеют сравнительно
минимальные колебания температуры в течение нескольких дней и сезонов, не представляют никаких экстремумов температуры на любой внутренней
поверхности и могут иметь внешний температурный дисплей, который автоматически регистрирует внутреннюю температуру в определенные промежутки времени.
Многие живые вакцины переносят замораживание, и в зависимости от конкретных инструкций производителя вместо этого замораживаются при температуре
от -15 до -50 °C. Среди обычно вводимых вакцин это включает только ветряную оспу и опоясывающий лишай, причем большинство других вакцин не охлаждаются.
Большинство невоспроизводящихся вакцин: инактивированные вирусы или бактерии, очищенные белковые субъединицы, углеводные антигены и рекомбинантные
субъединицы белковых антигенов вводятся вместе с адъювантами, такими как соли алюминия. Соли алюминия используются в вакцинах по всему миру уже почти
столетие, действуя для образования ионной связи с антигеном, представляющим интерес для вакцины, значительно улучшая стабильность и эффективность.
В более поздние годы была обнаружена дополнительная потенциально чрезвычайно важная цель в использовании адъювантов соли алюминия, поскольку они,
по-видимому, помогают стимулировать усиленный иммунный ответ хозяина после введения вместе с вакциной. Соли алюминия действуют на моноциты, макрофаги
и гранулоциты, индуцируя цитокины, создавая местную иммуностимулирующую среду. Они также могут вызывать местный некроз стромальных клеток, вызывая
высвобождение мочевой кислоты, которая затем активирует инфламмасомы.
В любом случае соли алюминия очень чувствительны к повреждению при замораживании, так как циклы замораживания-оттаивания вызывают агрегацию и
осаждение коллоидных частиц. Высокие температуры практически не влияют на структуру алюминиевого геля.
Действительно, повреждения от замораживания часто гораздо более эффективны, чем повреждения, связанные с нагревом, для вакцин, хотя большинство производителей
рекомендуют не позволять им находиться при комнатной температуре более тридцати минут, за исключением некоторых особых случаев. При экстремальных температурах,
приближающихся и превышающих 45 °С, белки, присутствующие в вакцине, относительно быстро денатурируются, в конечном счете полностью теряя свою эффективность,
поскольку структура антигена больше не присутствует.
Кумар и др. (1982) обнаружили, что вакцина против столбняка может выживать при температуре 35 °С в течение нескольких недель, в то время как при температуре
45 °С она испытывает потерю эффективности на 5% в день в течение первых двух недель хранения. При воздействии температуры 60 °C вакцина оказывалась полностью
неэффективной через три-пять часов. И наоборот, при хранении при температуре 30 °С в течение двенадцати часов противостолбнячная вакцина теряла около 30% своей
Белки, присутствующие в вакцине, могут быть непосредственно повреждены циклами замораживания-оттаивания несколькими механизмами.
Во время быстрого замораживания образуются мелкие кристаллики льда, которые обязательно представляют большую площадь поверхности для белков и поэтому
с большей вероятностью вступают в контакт, вызывая повреждение и частичное раскрытие.
Более крупные кристаллы льда наносят более серьезные повреждения, поглощая белки и потенциально повреждая контейнер с вакциной. При оттаивании процесс
рекристаллизации оказывает на белки напряжение сдвига.
Хранение вакцин при низких температурах также уменьшает потребность в других консервантах и снижает риск бактериального роста внутри вакцины. В вакцине
могут присутствовать различные другие химические вещества, такие как следы антибиотиков в процессе производства, стабилизаторы, такие как сорбит, и регуляторы
кислотности, такие как гистидин, все из которых, в свою очередь, могут подвергаться воздействию экстремальных температур.

Замена ранее установленных фармацевтических и бытовых холодильников, которые не обладают необходимыми характеристиками, на холодильники для "холодовой цепи" должна производиться в плановом порядке, либо при выходе из строя устаревшего оборудования (пункт 6.17. СП 3.3.2.3332-16).
Внутри холодильника ИЛП размещаются с учетом данных термокарты (при ее наличии). При загрузке холодильников растворители для вакцин и ИЛП, не допускающие замораживания, размещаются в удалении от источника холода. ИЛП, допускающие замораживание, могут размещаться вблизи источника холода на расстоянии не менее 10 см от него. Если термокарты на холодильник нет, то можно провести температурное картирование холодильника, чтобы выявить критические точки в камере. К каждой упаковке ИЛП в холодильнике должен быть обеспечен доступ охлажденного воздуха. В каждой камере холодильника предусматривается место для размещения хладоэлементов (не менее 1/6 общего объема холодильной камеры), которые служат дополнительными источниками холода при отключении электроснабжения холодильника.
Полки холодильника, выделенные для хранения отдельных ИЛП, должны быть промаркированы, кроме того сами ИЛП, как и любые другие лекарственные препараты должны быть идентифицированы с помощью стеллажных карт или кодов (при использовании системы электронной обработки данных) (п. 29 Приказа Минздрава РФ от 31.08.2016г. № 646н и п. 10 Приказа Минздравсоцразвития РФ от 23.08.2010г. № 706н).
Для замораживания и хранения хладоэлементов в аптеках должны быть морозильники (с объемом морозильной камеры не менее 50 литров).
Для контроля температурного режима при хранении и транспортировке ИЛП используются средства измерения температуры и средства выявления (индикации) нарушений температурного режима (представлены на рисунке ниже). Погрешность измерения температуры данных приборов должна быть не более 0,5 °C, интервал времени между соседними измерениями не более 1 минуты, что подтверждается в паспорте или инструкции по эксплуатации этого оборудования.
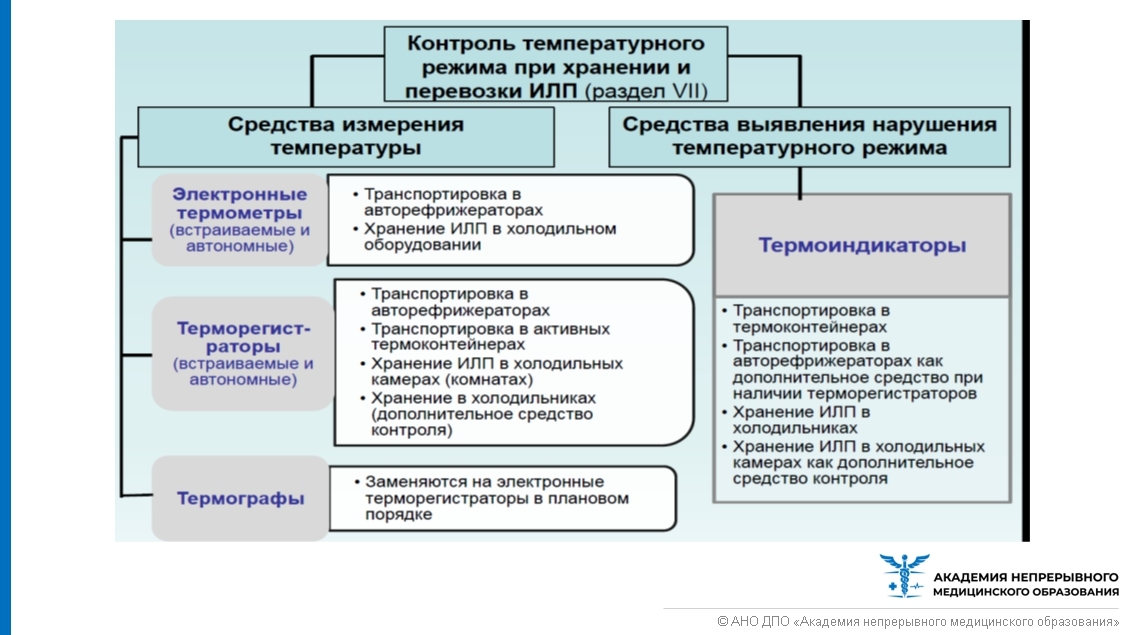
Наличие средств контроля температуры в зависимости от оборудования для хранения ИЛП представлено ниже.

В холодильниках автономные термометры и термоиндикаторы (терморегистраторы) размещаются рядом друг с другом непосредственно на коробках с ИЛП или непосредственно на полках в двух контрольных точках каждой камеры холодильника:
- наиболее "теплой" (наиболее удаленной от источника холода) и
- наиболее "холодной" (подверженной вероятному замораживанию, но не ближе 10 см к источнику холода).
В холодильной камере (комнате) еще и в центре на средней полке.
Электронную копию показаний терморегистраторов и их распечатку на бумажном носителе необходимо делать по мере необходимости, но не реже 1 раза в неделю и при возникновении чрезвычайных ситуаций.
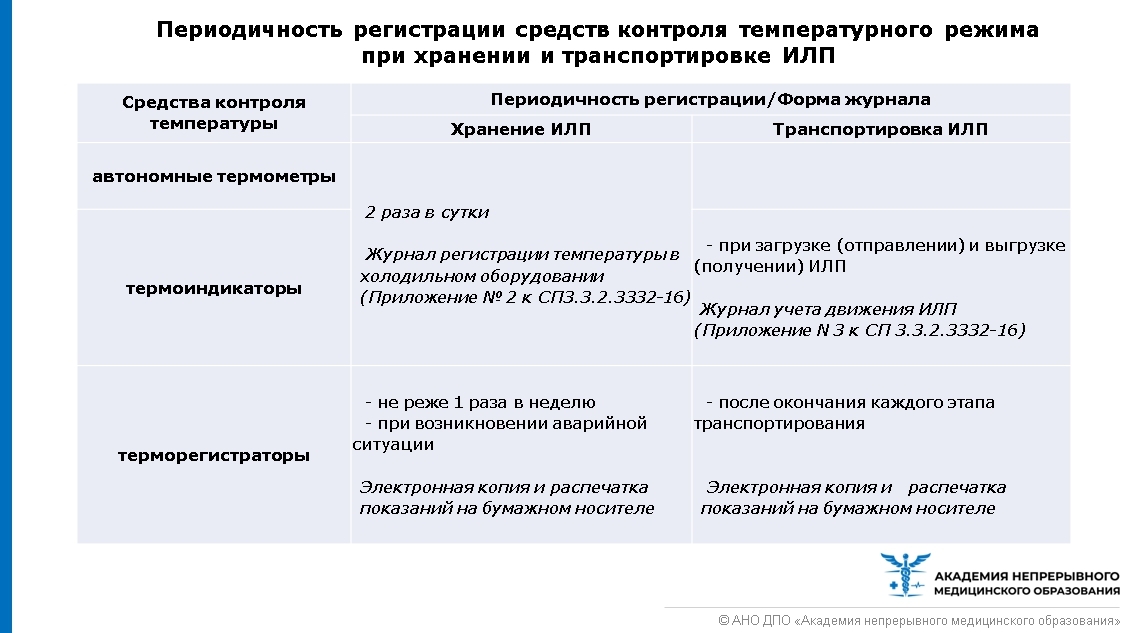
В СП 3.3.2.3332-16 нет указаний на сроки хранения Журналов регистрации температуры в холодильном оборудовании. По общим правилам (пункт 7 Приказа Минздравсоцразвития от 23.08.2010г. № 706н) такие журналы должны храниться в течение 1 года, не считая текущего. В проекте изменений в пункт 23 Приказа Минздрава РФ от 31.08.2016г. № 646н содержится требование о сроках хранения таких журналов в течение 1 года (сейчас в данном пункте – 2 года). Распечатки показаний терморегистраторов и их электронные копии хранятся в течение 1 года (п. 7.14. СП 3.3.2.3332-16).
Длительность хранения ИЛП в аптеках (п. 8.11.1 СП 3.3.2.3332-16)
- при отпуске в медицинские организации/структурные подразделения МО – отправка на 4 уровень - не более трех месяцев,
- при розничной реализации ИЛП - в течение срока годности препарата, но не позднее семи суток до его окончания.
При выявлении в аптеке серий (партий) ИЛП, обращение которых приостановлено или принято решение об их изъятии из обращения, необходимо переместить данные ИЛП в зону карантинного хранения (при приостановлении обращения), выделенную в холодильнике, или в зону хранения выявленных фальсифицированных, недоброкачественных, контрафактных ЛП, лекарственных препаратов с истекшим сроком годности с последующей передачей их на уничтожение или возвратом поставщику.

Перед утилизацией они должны подвергаться обязательному обеззараживанию (дезинфекции) или обезвреживанию. Обеззараживание в таких случаях, как правило, осуществляется теми организациями, которые производят уничтожение Перед утилизацией они должны подвергаться обязательному обеззараживанию (дезинфекции) или обезвреживанию. Обеззараживание в таких случаях, как правило, осуществляется теми организациями, которые производят уничтожение лекарственных препаратов. В СанПиН содержаться требования о необходимости хранения отходов класса Б до обеззараживания в отдельных помещениях и перевозка их отдельным транспортом, такие требования объяснимы при вскрытии упаковки с живой вакциной. Но в данном нормативном документе нет исключения для вакцин с целостной первичной упаковкой, поэтому необходимо в случае их списания и передачи на уничтожение соблюдать установленные требования.
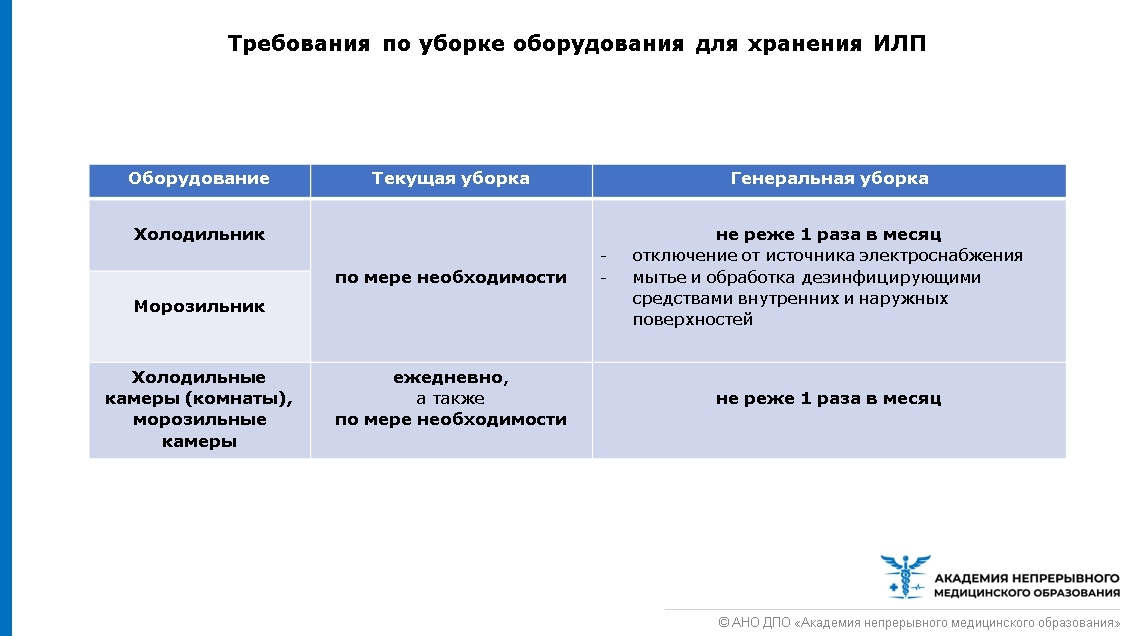
Требования по уборке оборудования для хранения ИЛП сдержатся в разделе VI СП 3.3.2.3332-16 (рисунок ниже).
Учет движения ИЛП.
Порядок отпуска ИЛП медицинским организациям/структурным подразделениям медицинских организаций (отправка на 4-й уровень).
Отпуск ИЛП из аптеки в медицинские организации (МО) или структурные подразделения МО осуществляется на основании требований-накладных (в том числе, если аптека является структурным подразделением МО). Требования-накладные оформляются в соответствии с требованиями Приказа Минздравсоцразвития РФ от 12.02.2007г. № 110.
При транспортировании ИЛП из аптеки, в том числе в обособленные структурные подразделения той же самой организации, должны выполняться все требования по транспортировке ИЛП (разделы V и VIII СП 3.3.2.3332-16):
- требования к автотранспорту и термоконтейнерам, в том числе их санитарная обработка;
- требования к средствам контроля температурного режима;
- правила загрузки ИЛП;
- требования к наличию дополнительных комплектов хладоэлементов и т.д.
В Журнале учета движения ИЛП (Приложение №3 к СП 3.3.2.3332-16) регистрируются данные о ИЛП, отправленных в МО/структурные подразделения МО, указываются данные термоиндикаторов, вложенных в термоконтейнеры. Напоминаем, что при использовании необходимо оформлять контрольные карточки термоиндикаторов.
Порядок отпуска ИЛП по рецептам.
План мероприятий по обеспечению "холодовой цепи" в чрезвычайных ситуациях.
В соответствии с разделом IX и Приложением № 4 СП 3.3.2.3332-16 в аптеке должен быть разработан и утвержден руководителем организации план мероприятий по обеспечению "холодовой цепи" в чрезвычайных ситуациях. План должен быть конкретным для каждой организации с указанием действий каждого должностного лица, с расчетом необходимого запаса термоконтейнеров, термоиндикаторов (терморегистраторов) и замороженных хладоэлементов и т.д.
Периодически (не реже одного раза в год) необходимо проводить учения по выполнению плана экстренных мероприятий по обеспечению "холодовой цепи" в чрезвычайных ситуациях с задействованием всех специалистов и с анализом работоспособности всего оборудования. По результатам учений следует вносить в план соответствующие коррективы.
Данная тема также широко рассматривается в рамках наших сертификационных курсов для провизоров и фармацевтов.
Автор статьи: Лариса Ивановна Гарбузова, доцент кафедры фармакологии и фармации СЗГМУ им. И.И. Мечникова
Читайте также:

