Можно ли расплавить соль на газовой плите
Обновлено: 25.04.2024
Закалка стали – один из наиболее важных процессов в термообработке металла, от которого напрямую зависит качество продукции. Плохая закалка может привести к излишней мягкости металла, перекаленная деталь, в свою очередь, становится очень хрупкой.
Виды закалки
Еще древние мастера, работавшие в кузнях, замечали, как тепловое воздействие в разной степени влияет на металл, меняя его структуру и свойства. С помощью термообработки можно улучшить механические характеристики детали, сделать ее более долговечной и даже уменьшить вес за счет увеличения прочности! В современном машиностроении задача комплексного улучшения эксплуатационных свойств металлических материалов в значительной степени связана с разработкой новых технологических процессов поверхностного упрочнения деталей. Термообработка позволяет даже изготавливать качественные детали из более дешевых сплавов, улучшая их характеристики до нужной отметки. Закалка стали – процесс термообработки, в результате которого сталь нагревается до критической температуры и быстро охлаждается. Цель такой обработки – повышение твердости и прочности детали с уменьшением ее пластичности.
Основные задачи, требующие решения при термообработке:
защита от обезуглероживания;
защита от цементации;
защита от окисления;
скорость охлаждения.
Для защиты от обезуглероживания, особенно быстрорежущей стали, рекомендуется применение растворов солевых ванн.
Подготовка раствора солей
В 95% рабочего объема тигля расплавляется соль Petrofer HS 760, после полного расплава добавляются 5% Petrofer NEUTROSAL. Небольшие порции NEUTROSAL посыпаются на ванну и сразу же перемешиваются. После этого следует нагрев до нужной температуры. О надежности необезуглероживания позволяет судить также и внешний вид ванны. Ванна должна быть прозрачной. На поверхности время от времени появляются язычки пламени, маленькие хлопья в ванне являются нормальными и представляют собой продукты реакции инертора с кислородом. Если ванна помутнеет, то в ней появились оксиды и растворенный кислород. В этом случае надежность необезуглероживания не обеспечивается.
Необезуглероживающий отжиг и закалка всех видов инструментальной стали и высокопроцентной хромистой стали, а также науглероженных деталей, в особенности, если цементованный слой местами обработан.
Обработка необезуглероживающим отжигом термически улучшенной или цементируемой стали (отжиг на крупное зерно).
Обезуглероживающий нагрев быстрорежущей стали до 1100°C. Обезуглероживающий твердый припой в солевой ванне.
Необходимо упомянуть, что при закалке в растворах солевых теплых ваннах поверхность деталей не окрашивается в иссиня-черный цвет, как это обычно происходит при закалке в ваннах, содержащих цианид. Поверхность обычно получается пестрой, светло-коричневого или красно-коричневого цвета.
Защита деталей от цементации
Цементация - один из главных процессов в термическом упрочнении деталей, поверхности которых работают на износ. К таким деталям относятся шестерни, вал-шестерни, сателлиты, полуоси, и многие другие изделия. Очень часто в процессе изготовления таких деталей, возникает необходимость исключить науглероживание на определенном участке. Такая необходимость возникает по разным причинам: требования конструкторской документации, требования по дальнейшей механической обработке и т.д. В связи с этим возникает вопрос о защите этих поверхностей от насыщения углеродом и исключения получения высокой твердости при последующей закалке сталей. Способ защиты деталей от цементации самый интересный и перспективный. Он заключается в использовании покрытий и защитных антицементационных паст Petrofer SURFATECT различного химического состава. Новые на водной основе и классические защитные пасты на основе растворителей для частичного покрытия от цементации, азотирования стальных деталей в газовой атмосфере. В зависимости от типа-оснастки защитных паст Petrofer SURFATECT легко растворяются в воде после обработки или удаляются механическим способом.
Оксидирование стали – это один из наиболее эффективных способов защиты поверхности металла от негативных внешних воздействий. В результате на металле образуется защитное покрытие в виде специфической пленки. Особенности и функции такой пленки напрямую зависят от метода оксидирования.
Оксидирование – для увеличения коррозионной стойкости. Для оксидирования применяют оксидирующие ванны. Petrofer Blacky при рабочей температуре до 150°C.
После термообработки деталей в расплавах солей детали промывают горячей водой, что не всегда благоприятно влияет на коррозионную стойкость, для решения данной проблемы применяется 2-3% раствор концентрата Petrofer AQUAPLUS 22. AQUAPLUS 22 применяется при необходимости надежной антикоррозийной защиты без значительных изменений физических свойств воды как, например, в системах охлаждения, при поверхностной закалке с применением индукционного нагрева и газопламенной закалки.
Для каждого вида закалки металла существует отдельный режим, определяющий исход процесса. Нужно учесть температуру нагрева, вычислить точное время и скорость нагрева, продолжительность выдержки детали при максимальном значении температуры, скорость охлаждения.
На атомном уровне при достижении критической температуры перестраивается атомная решетка.
Для разных марок стали существует своя критическая температура, в зависимости от уровня содержания углерода и примесей. Закалка делает металл твердым, но в то же время хрупким. Охлаждение детали должно проходить быстро, чтобы атомная структура не преобразовалась в промежуточную структуру. При этом слишком быстрое охлаждение может привести к растрескиванию стали или короблению. Во избежании брака скорость охлаждения при достижении порога в 200°С замедляют. Некоторые марки стали закаляются и при более высоких температурных режимах (1250–1300°С). Эти марки не подвержены растрескиванию, поэтому в предварительном подогреве они не нуждаются. Сложные детали, которые имеют резкие переходы или тонкие грани, предварительно подогревают в отдельных печах или соляных ваннах, применяя соли Petrofer AS 135. Температура подогрева – до 500°С.
Охлаждение металла – опасности и предосторожности!
В качестве основы для охлаждающих жидкостей используют воду. Водяная закалка имеет ряд недостатков. Главный минус – образование трещин и коробление металла, поэтому таким способом пользуются только при изготовлении цементированных изделий или изделий несложной формы, которые будут проходить финишную обработку. Изделия более сложной формы из конструкционной стали охлаждаются в растворе полимерных сред Petrofer AQUATENSID BW-FF. Охлаждение происходит равномерно; в отличие от закалки водой, не происходит смягчения и минимизируются разрушения. Огромное преимущество здесь – негорючесть, связанная с высоким содержанием воды, низким уровнем образования дыма и отсутствием паровой рубашки. Низкоконцентрированные растворы AQUATENSID BW-FF имеют охлаждающий эффект на уровне воды, но без их отрицательных свойств. Разумеется, неконтролируемое, неравномерное образование паровой оболочки на заготовке (феномен Лейденфроста) можно избежать. Применение AQUATENSID BW-FF с более высокой концентрацией дает характеристики охлаждения маслом. В области температур конвекционной фазы / мартенсита эффект охлаждения здесь уменьшается по сравнению с чистой водой. В результате неизбежно возникающие трансформационные напряжения не излишне накладываются высокими тепловыми напряжениями, трещины практически устраняются.

Термическая обработка легких металлов с помощью AQUATENSID
Легированные сплавы AL используются не только в авиации сегодня, но и в большей степени для легких конструкции в секторе транспортных средств. Закалка этих сплавов после гомогенизационного отжига, а также других сплавов AL после формования является еще одной областью применения для AQUATENSID. Из-за регулируемой скорости охлаждения, достигается снижение риска критических деформаций металла, в отличие от не контролируемой скорости охлаждения в воде. Таким образом, можно избежать серьезных усилий по переработке.
Полимерные растворы AQUATENSID также нашли множество применений при термообработке алюминиевых компонентов. Так, например, в аэрокосмической промышленности части прокаливаемого алюминиевого сплава длиной около 1,5 м с поперечными сечениями между 30 и 120 мм в 25% растворе полимера AQUATENSID почти без искажений охлаждаются, в отличие от охлаждения в воде. В случае повышенного риска растрескивания возможно использование водно-полимерной закалки Petrofer FEROQUENCH 2000.

Масла с обычной скоростью закалки Petrofer ISODUR 220 причем скорость при температуре 30°С, что при температуре 100°С она будет одинакова.
Масла, устойчивые к испарению для закалки с высокой интенсивностью охлаждения например ISORAPID 227 HM.
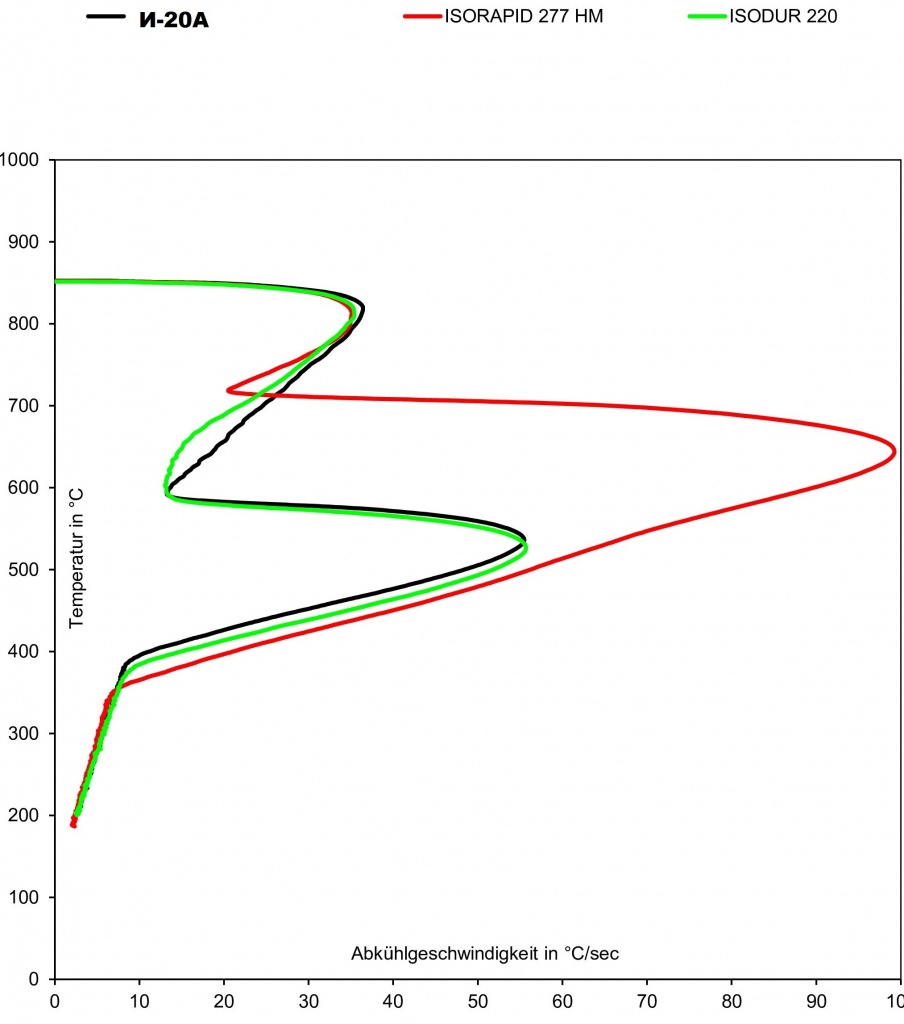
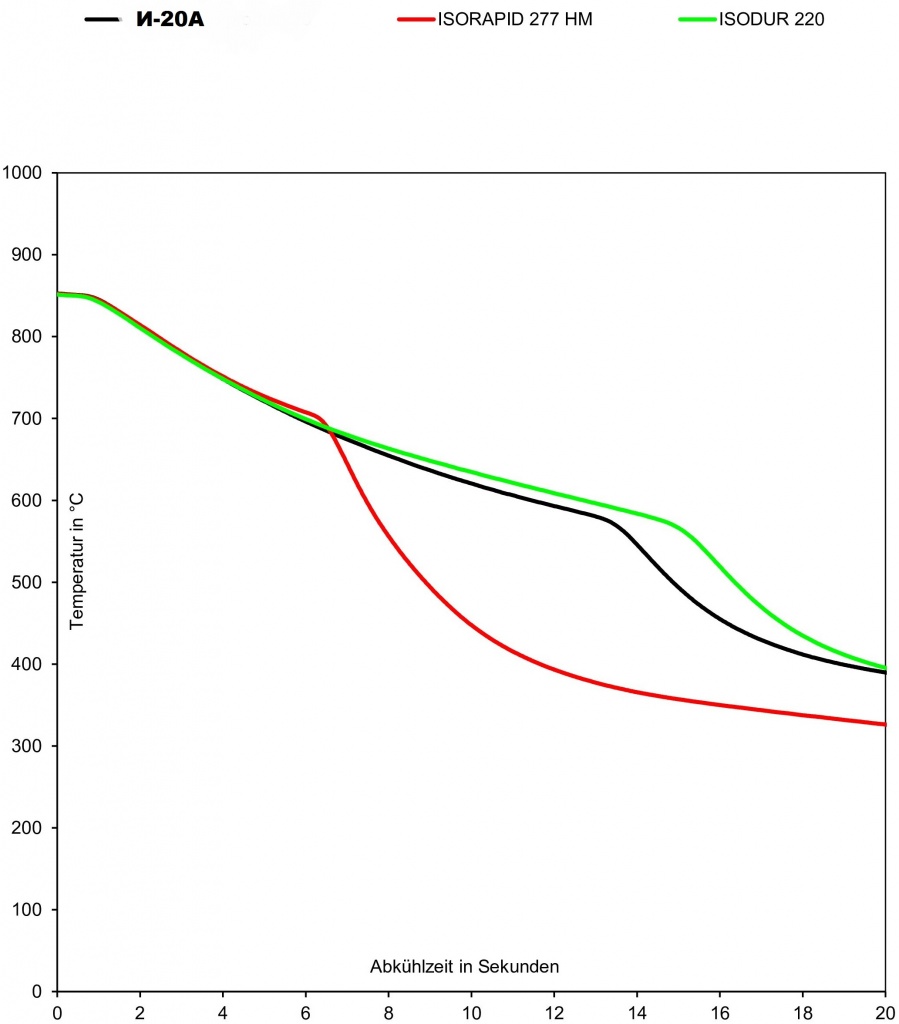
В частности, при использовании обычных масел для закалки сама среда имеет склонность к возгоранию. К тому же, со временем масло теряет закаливающие способности. При использовании масел, устойчивых к испарению для закалки с высокой интенсивностью охлаждения повышаются окислительные свойства, срок службы продукта, а главное качество закалки улучшается почти в два раза. Стойкость к окислению данных продуктов в пять раз выше по сравнению с индустриальным маслом - соответственно замена масла происходит намного реже.
Для оценки качества масла могут применяться и другие характеристики:
Температура вспышки - очень важное свойство в плане противопожарной безопасности. Как правило, не требуется применять масла с температурой вспышки на 50-60°С выше, чем температура процесса с учетом объема ванны масла и его теплопроводности.
Стойкость против старения - показатель экономической эффективности использования того или иного масла. Это время нормальной работы охлаждающей среды до образования продуктов горения и шлака на дне и стенках ванны. Время смены масла чаще определяется практически, по изменению цвета закаливаемых изделий или появлением мягких пятен на поверхности.
Еще одной экономической характеристикой качества масла является скорость уноса вещества с обрабатываемыми поверхностями деталей. Она не может быть однозначно определена, т.к. в большей степени зависит от конкретных условий использования (одиночный закалочный бак, бак в составе автоматической линии, с учетом времени на стекание или без учета). Однако эта характеристика находится в некоторой корреляции с вязкостью масла и чаще не превышает 1% площади обрабатываемых изделий.
При сравнении характеристик масел, нужно обращать внимание на допустимое количество воды и посторонних примесей.Вода в масле может быть причиной неравномерной твердости и возгорания закалочного бака. Чем больше воды в масле, тем больше вероятность этих явлений.

Несмотря на то, что алюминий имеет гораздо более высокую температуру плавления, по сравнению с оловом или свинцом, его довольно просто переплавить в домашних условиях с помощью обычной газовой горелки. В частности алюминиевые банки из-под различных напитков, которые так распространены, можно просто переплавить в металлические слитки.
Понадобится



Технология переплавки
Берем и плющим все банки ногой или молотком, стараясь сделать их как можно компактнее.

Устанавливаем форму для плавления на металлическое основание - в данном случае это корпус от блока питания компьютера. Зажигаем горелку. Смятую банку кладем в форму. И начинаем расправлять горелкой.

Через 10-15 секунд обильного обогрева банка расплавится.


Пока все не остыло добавляем ещё банку и тоже плавим.



Переливаем расплавленный алюминий в форму для заливки.

Продолжаема прогревать, чтобы все хорошенечко растеклось по форме.



Будьте осторожны: обязательно используйте средства защиты глаз и рук!

Смотрите видео
Перед изучением этого раздела рекомендую прочитать следующую статью:
Соли – это сложные вещества, которые состоят из катионов металлов и анионов кислотных остатков.

1. Соли можно получить взаимодействием кислотных оксидов с основными.
кислотный оксид + основный оксид = соль
Например , оксид серы (VI) реагирует с оксидом натрия с образованием сульфата натрия:
2. Взаимодействие кислот с основаниями и амфотерными гидроксидами. При этом щелочи взаимодействуют с любыми кислотами: и сильными, и слабыми.
Щелочь + любая кислота = соль + вода
Например , гидроксид натрия реагирует с соляной кислотой:
HCl + NaOH → NaCl + H2O
При взаимодействии щелочей с избытком многоосновной кислоты образуются кислые соли.
Например , гидроксид калия взаимодействует с избытком фосфорной кислоты с образованием гидрофосфата калия или дигидрофосфата калия:
Нерастворимые основания реагируют только с растворимыми кислотами.
Нерастворимое основание + растворимая кислота = соль + вода
Например , гидроксид меди (II) реагирует с серной кислотой:
Все амфотерные гидроксиды — нерастворимые. Следовательно, они ведут себя как нерастворимые основания при взаимодействии с кислотами:
Амфотерный гидроксид + растворимая кислота = соль + вода
Например , гидроксид цинка (II) реагирует с соляной кислотой:
Также соли образуются при взаимодействии аммиака с кислотами (аммиак проявляет основные свойства).
Аммиак + кислота = соль
Например , аммиак реагирует с соляной кислотой:


3. Взаимодействие кислот с основными оксидами и амфотерными оксидами. При этом растворимые кислоты взаимодействуют с любыми основными оксидами.
Растворимая кислота + основный оксид = соль + вода
Растворимая кислота + амфотерный оксид = соль + вода
Например , соляная кислота реагирует с оксидом меди (II):
2HCl + CuO → CuCl2 + H2O

4. Взаимодействие оснований с кислотными оксидами. Сильные основания взаимодействуют с любыми кислотными оксидами.
Щёлочь + кислотный оксид → соль + вода
Например , гидроксид натрия взаимодействует с углекислым газом с образованием карбоната натрия:
При взаимодействии щелочей с избытком кислотных оксидов, которым соответствуют многоосноосновные кислоты, образуются кислые соли.
Например , при взаимодействии гидроксида натрия с избытком углекислого газа образуется гидрокарбонат натрия:
NaOH + CO2 → NaHCO3
Нерастворимые основания взаимодействуют только с кислотными оксидами сильных кислот.
Например , гидроксид меди (II) взаимодействует с оксидом серы (VI), но не вступает в реакцию с углекислым газом:


5. Соли образуются при взаимодействии кислот с солями. Нерастворимые соли взаимодействуют только с более сильными кислотами (более сильная кислота вытесняет менее сильную кислоту из соли). Растворимые соли взаимодействуют с растворимыми кислотами, если в продуктах реакции есть осадок, газ или вода или слабый электролит.
Например: карбонат кальция CaCO3 (нерастворимая соль угольной кислоты) может реагировать с более сильной серной кислотой.
Силикат натрия (растворимая соль кремниевой кислоты) взаимодействует с соляной кислотой, т.к. в ходе реакции образуется нерастворимая кремниевая кислота:

6. Соли можно получить окислением оксидов, других солей, металлов и неметаллов (в щелочной среде) в водном растворе кислородом или другими окислителями.
Например , кислород окисляет сульфит натрия до сульфата натрия:
7. Еще один способ получения солей — взаимодействие металлов с неметаллами . Таким способом можно получить только соли бескислородных кислот.
Например , сера взаимодействует с кальцием с образованием сульфида кальция:
Ca + S → CaS
8. Соли образуются при растворении металлов в кислотах . Минеральные кислоты и кислоты-окислители (азотная кислота, серная концентрированная кислота) реагируют с металлами по-разному.
Кислоты-окислители реагируют с металлами с образованием продуктов восстановления азота и серы. Водород в таких реакциях не выделяется!
Минеральные кислоты реагируют по схеме:
металл + кислота → соль + водород
При этом с кислотами реагируют только металлы, расположенные в ряду активности левее водорода. А образуется соль металла с минимальной степенью окисления.
Например , железо растворяется в соляной кислоте с образованием хлорида железа (II):
Fe + 2HCl → FeCl2 + H2

9. Соли образуются при взаимодействии щелочей с металлами в растворе и расплаве. При этом протекает окислительно-восстановительная реакция, в растворе образуется комплексная соль и водород, в расплаве — средняя соль и водород.
! Обратите внимание! С щелочами в растворе реагируют только те металлы, у которых оксид с минимальной положительной степенью окисления металла амфотерный!
Например , железо не реагирует с раствором щёлочи, оксид железа (II) — основный. А алюминий растворяется в водном растворе щелочи, оксид алюминия — амфотерный:
2Al + 2NaOH + 6 H2 + O = 2Na[ Al +3 (OH)4] + 3 H2 0
10. Соли образуются при взаимодействии щелочей с неметаллами. При этом протекают окислительно-восстановительные реакции. Как правило, неметаллы диспропорционируют в щелочах. Не реагируют с щелочами кислород, водород, азот, углерод и инертные газы (гелий, неон, аргон и др.):
NaOH +О2 ≠
NaOH +N2 ≠
NaOH +C ≠
Сера, хлор, бром, йод, фосфор и другие неметаллы диспропорционируют в щелочах (т.е. самоокисляются-самовосстанавливаются).
Например , хлор при взаимодействии с холодной щелочью переходит в степени окисления -1 и +1:
2NaOH + Cl2 0 = NaCl — + NaOCl + + H2O
Хлор при взаимодействии с горячей щелочью переходит в степени окисления -1 и +5:
6NaOH + Cl2 0 = 5NaCl — + NaCl +5 O3 + 3H2O
Кремний окисляется щелочами до степени окисления +4.
Например , в растворе:
2NaOH + Si 0 + H2 + O= Na2Si +4 O3 + 2H2 0
Фтор окисляет щёлочи:
2F2 0 + 4NaO -2 H = O2 0 + 4NaF — + 2H2O
Более подробно про эти реакции можно прочитать в статье Окислительно-восстановительные реакции.
11. Соли образуются при взаимодействии солей с неметалами. При этом протекают окислительно-восстановительные реакции. Один из примеров таких реакций — взаимодействие галогенидов металлов с другими галогенами. При этом более активный галоген вытесняет менее активный из соли.
Например , хлор взаимодействует с бромидом калия:
2KBr + Cl2 = 2KCl + Br2
Но не реагирует с фторидом калия:
KF +Cl2 ≠
1. В водных растворах соли диссоциируют на катионы металлов Ме + и анионы кислотных остатков. При этом растворимые соли диссоциируют почти полностью, а нерастворимые соли практически не диссоциируют, либо диссоциируют только частично.
Например , хлорид кальция диссоциирует почти полностью:
CaCl2 → Ca 2+ + 2Cl –
Кислые и основные соли диссоциируют cтупенчато. При диссоциации кислых солей сначала разрываются ионные связи металла с кислотными остатком, затем диссоциирует кислотный остаток кислой соли на катионы водорода и анион кислотного остатка.
Например , гидрокарбонат натрия диссоциирует в две ступени:
NaHCO3 → Na + + HCO3 –
HCO3 – → H + + CO3 2–
Основные соли также диссоциируют ступенчато.
Например , гидроксокарбонат меди (II) диссоциирует в две ступени:
CuOH + → Cu 2+ + OH –
Двойные соли диссоциируют в одну ступень.
Например , сульфат алюминия-калия диссоциирует в одну ступень:
Смешанные соли диссоциируют также одноступенчато.
Например , хлорид-гипохлорид кальция диссоциирует в одну ступень:
CaCl(OCl) → Ca 2+ + Cl — + ClO –
Комплексные соли диссоциируют на комплексный ион и ионы внешней сферы.
Например , тетрагидроксоалюминат калия распадается на ионы калия и тетрагидроксоалюминат-ион:

2. Соли взаимодействуют с кислотными и амфотерными оксидами . При этом менее летучие оксиды вытесняют более летучие при сплавлении.
соль1 + амфотерный оксид = соль2 + кислотный оксид
соль1 + твердый кислотный оксид = соль2 + кислотный оксид
соль + основный оксид ≠
Например , карбонат калия взаимодействует с оксидом кремния (IV) с образованием силиката калия и углекислого газа:
Карбонат калия также взаимодействует с оксидом алюминия с образованием алюмината калия и углекислого газа:
4. Растворимые соли взаимодействуют с щелочами. Реакция возможна, только если образуется газ, осадок, вода или слабый электролит, поэтому с щелочами взаимодействуют, как правило, соли тяжелых металлов или соли аммония.
Растворимая соль + щелочь = соль2 + основание
Например , сульфат меди (II) взаимодействует с гидроксидом калия, т.к. образуется осадок гидроксида меди (II):
Хлорид аммония взаимодействует с гидроксидом натрия:
Кислые соли взаимодействуют с щелочами с образованием средних солей.
Кислая соль + щелочь = средняя соль + вода
Например , гидрокарбонат калия взаимодействует с гидроксидом калия:

5. Растворимые соли взаимодействуют с солями. Реакция возможна, только если обе соли растворимые, и в результате реакции образуется осадок.
Растворимая соль1 + растворимая соль2 = соль3 + соль4
Растворимая соль + нерастворимая соль ≠
Например , сульфат меди (II) взаимодействует с хлоридом бария, т.к. образуется осадок сульфата бария:
Некоторые кислые соли взаимодействуют с кислыми солями более слабых кислот. При этом более сильные кислоты вытесняют более слабые:
Кислая соль1 + кислая соль2 = соль3 + кислота
Например , гидрокарбонат калия взаимодействует с гидросульфатом калия:
Некоторые кислые соли могут реагировать со своими средними солями.
Например , фосфат калия взаимодействует с дигидрофосфатом калия с образованием гидрофосфата калия:

6. C оли взаимодействуют с металлами. Более активные металлы (расположенные левее в ряду активности металлов) вытесняют из солей менее активные.
Например , железо вытесняет медь из раствора сульфата меди (II):
CuSO4 + Fe = FeSO4 + Cu
А вот серебро вытеснить медь не сможет:
CuSO4 + Ag ≠
Обратите внимание! Если реакция протекает в растворе, то добавляемый металл не должен реагировать с водой в растворе. Если мы добавляем в раствор соли щелочной или щелочноземельный металл, то этот металл будет реагировать преимущественно с водой, а с солью будет реагировать незначительно.
Например , при добавлении натрия в раствор хлорида цинка натрий будет взаимодействовать с водой:
2H2O + 2Na = 2NaOH + H2
Образующийся гидроксид натрия, конечно, будет реагировать с хлоридом цинка:
ZnCl2 + 2NaOH = 2NaCl + Zn(OH)2
Но сам-то натрий с хлоридом цинка, таким образом, взаимодействовать напрямую не будет!
ZnCl2(р-р) + Na ≠
А вот в расплаве эта реакция при определенных условиях уже может протекать, так как в расплаве никакой воды нет.
ZnCl2(р-в) + 2Na = 2NaCl + Zn
И еще один нюанс. Чтобы получить расплав, соль необходимо нагреть. Но многие соли при нагревании разлагаются. И реагировать с металлом, естественно, при этом не могут. Таким образом, реагировать с металлами в расплаве могут только те соли, которые не разлагаются при нагревании. А разлагаются при нагревании почти все нитраты, нерастворимые карбонаты и некоторые другие соли.
Например , нитрат меди (II) в расплаве не реагирует с железом, так как при нагревании нитрат меди разлагается:
Образующийся оксид меди, конечно, будет реагировать с железом:
CuO + Fe = FeO + Cu
Но сам-то нитрат меди, получается, с железом реагировать напрямую не будет!

При добавлении меди (Cu) в раствор соли менее активного металла – серебра (AgNO3) произойдет химическая реакция:
2AgNO3 + Cu = Cu(NO3)2 + 2Ag
При добавлении железа (Fe) в раствор соли меди (CuSO4) на железном гвозде появился розовый налет металлической меди:
CuSO4 + Fe = FeSO4 + Cu
При добавлении цинка в раствор нитрата свинца (II) на цинке образуется слой металлического свинца:
7. Некоторые соли при нагревании разлагаются .
Соли, в составе которых есть сильные окислители, разлагаются с окислительно-восстановительной реакцией. К таким солям относятся:
NH4NO3 → N2O + 2H2O
NH4NO2 → N2 + 2H2O
(NH4)2Cr2O7 → N2 + 4H2O + Cr2O3
2AgNO3 → 2Ag +2NO2 + O2
2AgCl → 2Ag + Cl2
Некоторые соли разлагаются без изменения степени окисления элементов. К ним относятся:
MgСO3 → MgO + СО2
2NaНСО3 → Na2СО3 + СО2 + Н2О
- Карбонат, сульфат, сульфит, сульфид, хлорид, фосфат аммония:
NH4Cl → NH3 + HCl
(NH4)2CO3 → 2NH3 + CO2 + H2O
(NH4)2SO4 → NH4HSO4 + NH3

7. Соли проявляют восстановительные свойства . Как правило, восстановительные свойства проявляют либо соли, содержащие неметаллы с низшей степенью окисления, либо соли, содержащие неметаллы или металлы с промежуточной степенью окисления.
Например , йодид калия окисляется хлоридом меди (II):
4KI — + 2Cu +2 Cl2 → 4KCl + 2Cu + l + I2 0

8. Соли проявляют и окислительные свойства . Как правило, окислительные свойства проявляют соли, содержащие атомы металлов или неметаллов с высшей или промежуточной степенью окисления. Окислительные свойства некоторых солей рассмотрены в статье Окислительно-восстановительные реакции.

Этот совет на данный момент актуален и для меня. Может быть пригодится еще кому-то. Буду рада.
Не так давно я купил новую газовую плиту на кухню. Она мне очень понравилась, так как старая была уже совсем старая. Я ее давно хотела сменить.
И вот моя мечта сбылась.
В целом плитой я довольна, но вот духовка… Выпечка в ней хоть и получается вкусная, но не подрумянивается сверху, остается бледная.
Что я только не делала, и смазывала верх пирогов и пирожков молоком, желтком, молоком, смешанным с желтком.
Ничего не помогало. Верх оставался бледный.
И вот тогда-то я и вспомнила одну бабушкину хитрость. А именно противень с солью.
Противень с солью

Моя бабушка пекла самые вкусные пироги. Буквально все восхищались ими. Ее пироги всегда были не только вкусными, но и имели очень аппетитный внешний вид и аппетитную румяную корочку.
У нее всегда в духовке стоял противень, на который была высыпана целая упаковка, а может даже и две обычной поваренной соли.
Слава Богу, что я не стала выбрасывать противень от старой плиты. Вот он мне и пригодился.
В чем смысл?
Я достала противень от старой плиты и высыпала на него 2 упаковки крупной соли.
Разровняла, чтобы получился ровный слой и поставила этот противень на самую верхнюю полку духовки.
Во время работы духовки, соль тоже будет нагреваться и удерживать жар.
Благодаря этому дополнительному жару на выпечке и будет получатся румяная корочка.

Я проверила на деле. И это действительно так.
Посмотрите какая румяная получилась корочка на пироге.

Соль после того, как все испеклось убирать из духовки не нужно. Пусть она стоит там. Она может прослужить не один год.

Пусть она пожелтеет или спечется, это неважно. На температурные качества соли это не влияет никоим образом.
Соль поможет сохранить ровную температуру в духовом шкафу и выпечка всегда будет идеальной.
Читайте также:

