Какой фактор лежит в основе развития вентилятор ассоциированного повреждения легких
Обновлено: 27.04.2024
В 1994 г. на Американо-Европейской согласительной конференции (АЕСК) было предложено следующее определение острого респираторного дистресс-синдрома:
Помимо этого, на AECK было предложено выделять две формы данного заболевания:
1. Острое повреждение легких (ОПЛ) (acute lung injury), которое включает в себя как начальный, более легкий, этап заболевания, так и наиболее тяжелые формы.
2. Собственно ОРДС, являющийся наиболее тяжелым заболеванием.
Таким образом, любой ОРДС можно отнести к ОПЛ, но не все формы ОПЛ являются ОРДС.
В 2012 г. Европейское общество интенсивной терапии (ESICM) иницировало новый подход к проблеме, результатом которого стало так называемое Берлинское соглашение (консенсус) по ОРДС. Согласно этому соглашению, ОРДС получил новое определение:
Острый респираторный дистресс-синдром - это острое, диффузное, воспалительное поражение легких, ведущее к повышению проницаемости сосудов легких, повышению массы легких и уменьшению аэрации легочной ткани.
Основные клинико-физиологические звенья: гипoксемия и двусторонние инфильтраты на рентгенограмме органов грудной клетки, увеличение венозного шунтирования, рост физиологического мертвого пространства, снижение податливости легочной ткани.
Термин "острое повреждение легких" был исключен, ввиду того, что многие клиницисты на практике стали так называть любую нетяжелую гипоксемию.
Примечание. В связи с изменением определения и отсутствием исследований, соответствующих новым критериям, далее в тексте рубрики иногда будет встречаться старый термин ОПЛ (СОПЛ).
Период протекания
Чаще всего почти у всех пациентов между фактором, вызвавшим поражение, и ОРДС, проходит не менее 72 часов и не более 7 дней.

Автоматизация клиники: быстро и недорого!
- Подключено 300 клиник из 4 стран
- 800 RUB / 4500 KZT / 27 BYN - 1 рабочее место в месяц

Автоматизация клиники: быстро и недорого!
- Подключено 300 клиник из 4 стран
- 1 место - 800 RUB / 4500 KZT / 27 BYN в месяц
Мне интересно! Свяжитесь со мной
Классификация
Согласно Берлинскому консенсусу ESICM - 2012, имеются три взаимоисключающие формы острого респираторного дистресс-синдрома:
- легкий;
- средней тяжести;
- тяжелый.
Разделение на указанные выше формы осуществляется по тяжести нарушения оксигенации (гипоксемии):
2. Умеренная: 100 мм рт.ст.
Этиология и патогенез
Острый респираторный дистресс-синдром (ОРДС) может быть следствием “прямого” или “непрямого” повреждения легких.
“Непрямой” механизм ОПЛ/ОРДС связан с внелегочными заболеваниями, при которых в результате системной воспалительной реакции организма возникает повреждение легких. То есть повреждение легких ассоциировано с повреждающими эффектами цитокинов и других биохимических и клеточных медиаторов.
Примечания:
1 Сепсис с двумя или более факторами из группы "А" + один или более признаков из группы "Б". Наибольшая вероятность развития ОРДС (23% против 8%) возникает при сепсисе вызванном грамнегативной флорой.
Группа признаков "А":
- температура выше 38,5 о или ниже 36 о;
- число лейкоцитов более 12х10 9 /мкл или менее 3х10 9 /мкл;
- установленный гнойный очаг;
- выделение гемокультуры.
Группа признаков "Б":
- артериальная гипотония в течение 2 и более часов, систолическое артериальное давление 85 мм.рт.ст;
- метаболический ацидоз - ВЕ менее 5 ммоль/л;
| Риск | Fowler, 1983 | Shelling, 1998 | Hudson, 1995 |
| Бактериемия | 3,8 | ||
| Сепсис | 28,8 | 41,2 | |
| Травма | 33,3 | 25,5 | |
| Переломы | 5,3 | 11,1 | |
| Контузия легких | 21,8 | ||
| Ожоги | 2,3 | ||
| Тяжелая пневмония | 11,9 | 27,3 | |
| ДВС-синдром | 22,2 | ||
| Аспирация | 35,6 | 22,0 | |
| Утопление | 33,3 | ||
| Передозировка наркотиков | 8,5 | ||
| Неизвестная причина | 22,7 | 10,6 | 21,1 |
Воспаление при ОРДС проходит следующие патофизиологические стадии:
Механика дыхания
У пациентов с ОРДС наблюдаются выраженные изменения механики дыхания.
Статический комплаенс респираторной системы (Crs), представляющий собой изменение легочного объема на заданное изменение транспульмонального давления, у больных ОРДС практически всегда снижен.
Согласно исследованиям, в которых использовались пищеводные катетеры, легочный комплаенс CL также снижен до 32-72 мл/см H2O (40-60% от нормы), комплаенс грудной клетки Ccw составляет 59-147 мл/см H2O (50-80% от нормы). Ccw снижен вследствие нарушений эластических свойств грудной клетки и стенок брюшной полости (повышение давления в брюшной полости и повышение ригидности стенок).
Поскольку статический комплаенс не дает информации о региональных особенностях легких у больных ОРДС, большое значение приобретает оценка кривой “давление-объем”. Данная кривая обычно строится во время инфляции в дыхательные пути последовательных порций заданных объемов с помощью большого шприца (super-syringe method).
Полученная кривая имеет два “колена”: нижнее “колено” (low inflection point) и верхнее “колено” (upper inflection point). Считается, что альвеолы находятся в спавшемся, коллабированном состоянии при уровне давления менее точки нижнего “колена”; альвеолы перерастянуты при давлении больше точки верхнего “колена”. В идеале во время респираторной поддержки колебания положительного давления в дыхательных путях больного должны происходить между точками верхнего и нижнего “колен”.
При ОРДС также, как правило, значительно повышены все компоненты сопротивления в дыхательных путях. Такие изменения обусловлены накоплением клеточных элементов и жидкости в дыхательных путях, отеком бронхов, бронхиальной гиперреактивностью, уменьшением легочных объемов и количества функционирующих дыхательных путей.
Легочная гемодинамика
Повышение давления в легочной артерии - достаточно типичный признак ОРДС. Среднее давление в легочной артерии обычно составляет около 30 мм рт. ст. Вследствие легочной гипертензии у больных ОРДС возникают нарушение функции правого желудочка, снижение сердечного выброса и снижение транспорта кислорода к тканям. Легочная гипертензия также может выступать дополнительным фактором развития полиорганной недостаточности.
Легочная гипертензия при ОРДС, как правило, имеет мультифакторный генез: гипоксическая вазокoнстрикция, вазоспазм, вызванный вазоактивными медиаторами (тромбоксан, лейкотриены и эндотелин), внутрисосудистая обструкция тромбоцитарными тромбами и периваскулярный отек.
На поздних этапах ОРДС большую роль могут играть такие механизмы, как фиброз и облитерация легочных сосудов (ремоделирование).
Эпидемиология
Заболеваемость острым респираторным дистресс-синдромом (ОРДС) варьирует в широких пределах, частично вследствие того, что при исследованиях использовались различные определения этого заболевания. Статистика из США и статистика, приведенная в международных исследованиях, могут, хотя и не бесспорно, прояснить истинную частоту этого заболевания.
В 1970-х годах, когда Национальный Институт Здоровья (NIH) начал изучение ОРДС, по некоторым оценкам, ежегодная частота составляла 75 случаев на 100000 населения. Данные, полученные в последнее время из NIH-спонсируемых исследований ОРДС, позволяют предположить, что частота ОРДС на самом деле может быть выше первоначальной оценки. В проспективном исследовании с использованием критериев Американо-Европейской согласительной конференции (АЕСК) 1994 года выявлено, что с поправкой на возраст заболеваемость острым повреждением легких (ОПЛ) составляет 86,2 на 100000 человеко-лет. С возрастом заболеваемость увеличивается до 306 случаев на 100000 человеко-лет для людей в возрасте 75-84 лет.
На основании этих статистических данных, по оценкам экспертов, в США ежегодно регистрируется 190 600 случаев ОРДС и что эти случаи связаны с 74500 смертей.
В первом исследовании с использованием критериев AECK 1994 года в Скандинавии, годовой показатель составил 17,9 случаев ОПЛ на 100000 населения и 13,5 случаев ОРДС на 100000 населения.
Российская Федерация
При острой хирургической и соматической патологии синдром ОПЛ развивается в среднем у 15,4±3,6% больных, а ОРДС - у 11,7±4,7%.
В различных регионах Российской Федерации частота ОРДС у взрослых в 2001-2002 годах находилась в пределах 4,8±0,9 - 7,5±0,9 случаев на 100 000 населения в год. На 1000 больных, переводимых в отделения анестезиологии и реанимации клинических медицинских учреждений, в год частота ОРДС достигала 22,7±8,6%.
ОРДС может возникнуть у людей любого возраста. Его частота увеличивается с возрастом, от 16 случаев на 100000 человеко-лет у лиц в возрасте 15-19 лет до 306 случаев на 100000 человеко-лет у лиц в возрасте 75 и 84 лет. Распределение по возрасту отражает заболеваемость в связи с основными причинами развития ОРДС.
Для ОРДС, связанного с сепсисом и большинством других причин, никаких различий в заболеваемости между мужчинами и женщинами по всей видимости, не существуют. Тем не менее, только у травматологических больных , заболеваемость может быть немного выше среди женщин.
Приблизительное распределение по тяжести ОРДС (согласно анализу баз данных при выработке Берлинского соглашения 2012 года):
- легкий ОРДС ((по сути - ОПЛ из старой классификации)) - 22% больных клинической базы данных (95% ДИ 21-24%);
Факторы и группы риска
Клиническая картина
Клинические критерии диагностики
диспноэ, дискомфорт в грудной клетке, сухой кашель, цианоз, тахипноэ, тахикардия, участие в дыхании вспомогательных мышц, диффузная крепитация, жесткое, а иногда и бронхиальное “амфорическое” дыхание; расстройство сознания.
Cимптомы, течение
Возникновение острого респираторного дистресс-синдрома (ОРДС) наиболее часто происходит в первые 12-48 часов от начала развития основного заболевания или события. В ряде случаев возможно развитие ОРДС и спустя 5 дней.
Облигатный признак ОРДС - гипоксемия (SpO2 ниже 90%, часто - ниже 75%).
Больные с ОРДС практически всегда рефрактерны к терапии кислородом, что отражает основной механизм нарушения газообмена при ОРДС – развитие внутрилегочного шунта.
Диагностика
Критерии Delphi - 2005
4. Некардиогенный характер определяется по субъективным признакам (отсутствие клиники сердечной недостаточности).
5a. Некардиогенный характер определяется по объективным признакам (ДЗЛК ДЗЛК - давление заклинивания в легочных капиллярах
40%).
Диагноз ОРДС, согласно критериям Delphi, выставляется при наличии первых четырех признаков + один признак 5а или 5b.
1. Временной интервал: возникновение синдрома (новые симптомы или усугубление симптомов поражения легких) в пределах одной недели от момента действия известного причинного фактора.
3. Механизм отека: дыхательную недостаточность нельзя объяснить сердечной недостаточностью или перегрузкой жидкостью. Если факторов риска сердечной недостаточности нет, необходимы дополнительные исследования, прежде всего эхокардиография.
4. Нарушение оксигенации (гипоксия):
- легкая: 200 мм рт.ст. КТВР - компьютерная томография высокого разрешения
).
Тяжелый ОРДС предполагает затемнение минимум 3-4 полей.
Характерная рентгенологическая находка - возникновение картины “матового стекла” и диффузных мультифокальных инфильтратов довольно высокой плотности с хорошо очерченными воздушными бронхограммами, то есть развитие обширного поражения паренхимы легких.
Часто может визуализироваться небольшой плевральный выпот.
Определенные трудности возникают при дифференциации рентгенографической картинй ОРДС с кардиогенным отеком легких. В пользу ОРДС свидетельствуют:
- более периферическое расположение инфильтративных теней;
- нормальные размеры сердечной тени;
- отсутствие или небольшое количество линий Керли Линии Керли - горизонтальные линейные тени на рентгенограмме нижних отделов легких, наблюдаемые при уплотнении (отеке) междольковых перегородок, например у больных с легочной гипертензией
типа В (короткие, параллельные, располагающиеся на периферии легких).
На рентгенологическую картину ОРДС могут влиять терапевтические вмешательства. Например, избыточное введение растворов может привести к усилению альвеолярного отека и усилению выраженности рентгенологических изменений; терапия диуретиками, наоборот, может уменьшить рентгенологические изменения. Уменьшение регионарной плотности легких, приводящее к ошибочному впечатлению об улучшении патологического процесса, может быть вызвано искусственной вентиляцией легких (в особенности при использовании РЕЕР), которая повышает среднее давление в дыхательных путях и инфляцию легких.
На поздних этапах развития ОРДС очаги консолидации сменяются интерстициальными изменениями, возможно появление кистозных изменений.
Компьютерная томография (КТ) позволяет получить данные, которые не могут быть получены при обычной рентгенографии. В частности, получить дополнительную информацию о степени и протяженности поражения паренхимы легких, а также выявить наличие баротравмы Баротравма - повреждение воздухсодержащих органов (ухо, придаточные пазухи носа, легкие), вызванное разницей давлений между внешней средой (газ или жидкость) и внутренними полостями
или локализованной инфекции.
Ранние КТ-исследования структуры легких показали, что локализация легочных инфильтратов носит пятнистый, негомогенный характер, причем существует вентрально-дорсальный градиент легочной плотности:
- нормальная аэрация легочной ткани в вентральных (так называемых независимых) отделах;
- картина “матового стекла” в промежуточных зонах;
- плотные очаги консолидации в дорсальных (зависимых) отделах.
Возникновение плотных очагов в дорсальных отделах обусловдено зависимым от силы тяжести распределением отека легких и, в большей степени, развитием “компрессионных ателектазов” зависимых зон вследствие их сдавления вышележащими отечными легкими.
Из критериев диагностики в Берлинских соглашениях - 2012 устранено давление в левом предсердии, поскольку в настоящее время редко используют соответствующий катетер.
Предполагать развитие ОРДС возможно в тех случаях, когда нарастающая дыхательная недостаточность не может быть объяснена сердечной недостаточностью и перегрузкой жидкостью.
В случае отсутствия явной причины ОРДС требуется проведение дополнительных исследований. Например, эхокардиоскопии для исключения застоя в легких.
Оксигенация. Согласно Берлинским соглашениям - 2012, минимальный уровень ПДКВ, при котором замеряется отношение PaO2/FiO2, составляет 5 см вод. ст., для тяжелого ОРДС – 10 см вод.ст.
Дополнительные показатели
Поскольку измеить мертвое пространство в клинике нелегко, специалисты рекомендуют использовать взамен минутную легочную вентиляцию, стандартизированную к PaCO2 40 мм рт.ст. (VECORR = МВЛ * PaCO2/40). Для определения ОРДС предложено использовать высокую VECORR > 10 л/мин. или низкий комплайенс (
Лабораторная диагностика
Лабораторные признаки малоспецифичны для ОРДС. За исключением кислотно-щелочного состояния (КЩС), большинство лабораторных признаков связаны с основным заболеванием, поскольку ОРДС часто сопутствует системной воспалительной реакции организма на инфекцию или другие факторы.
2. Общий анализ крови:
- лейкоцитоз или лейкопения;
- анемия;
- нередко - тромбоцитопения, отражающачя системную воспалительную реакцию или повреждение эндотелия.
3. Биохимия: возможно выявление недостаточности функции печени (цитолитиз, холестаз) или почек (повышение креатинина, мочевины). это связано с тем, что ОРДС часто является проявлением полиорганной недостаточности.
4. Бронхоальвеолярный лаваж. В первые дни заболевания характерной находкой у больных ОРДС является высокое содержание нейтрофилов – более 60% (в норме менее 5%), которое по мере обратного развития заболевания уступает место альвеолярным макрофагам.
Дифференциальный диагноз
Проводят дифференциальную диагностику ОРДС со следующими заболеваниями:
1. Кардиогенный отек легких. Для исключения данного заболевания проводится эхокардиография.
2. Острая интерстициальная пневмония является редкой и быстро прогрессирующей формой поражения легких. Характерные проявления: эозинофилия и нейтрофилия жидкости, полученной при бронхоальвеолярном лаваже (БАЛ). Для подтверждения диагноза проводят патогистологическое исследование.
3. Идиопатическая острая эозинофильная пневмония развивается на фоне полного здоровья и проявляется кашлем, одышкой, лихорадкой, иногда болью в грудной клетке. Содержание эозинофилов (обычно порядка 40%) повышено в крови и в жидкости, полученной при БАЛ. Заболевание имеет место быстрый ответ на кортикостероиды (в течение 48 часов).
4. Диффузное альвеолярное кровоизлияние определяется если у пациента с признаками острой респираторной недостаточности присутствует резкое снижение содержания гемоглобина в крови. При бронхоскопии, как правило, видна кровь, даже при отсутствии кровохарканья. Диагностическое значение имеет появление макрофагов, насыщенных гемосидерином, через 48 часов после начала заболевания.
5. Злокачественное новообразование (в особенности лимфогенный карциноматоз) может симулировать картину ОРДС в случае быстрого диссеминирования в тканях легких. Для дифференциации применяют бронхоскопию с БАЛ и биопсией.
Сокращение времени проведения экстракорпоральной мембранной оксигенации у взрослых пациентов с H1N1-ассоциированной пневмонией при помощи волюметрического диффузионного респиратора.
Andrew J. Michaels, M.D., Jonathan G. Hill, M.D., William B. Long, M.D., Bernie P. Sperley, D.O., Brian P. Young, M.D., Paulene K. Park, M.D., Peter T. Rycus, B.S., Robert H. Bartlett, M.D.
Legacy Emanuel Medical Center, Portland, OR, USA; University of Michigan, Ann Arbor, MI, USA
При острой легочной недостаточности оксигенация и вентиляция пациента становится невозможной. Механическая вентиляция сама по себе может быть причиной повреждения легких. Существуют различные методы защитной вентиляции, однако даже они не во всех случаях могут оказать пациенту необходимую поддержку: в частности, когда речь идет об остром респираторном дистресс-синдроме (ОРДС). В течение многих лет для восстановления нормального газообмена при ОРДС используется экстракорпоральная мембранная оксигенация (ЭКМО). Но этот метод также обладает определенными недостатками, среди которых осложнения, связанные с введением антикоагулянтов и некоторыми другими особенностями процедуры, а также невероятно высокая стоимость одного дня ЭКМО. Поэтому любая стратегия, которая позволяет ускорить восстановление легких и уменьшить время пребывания пациента на аппарате ЭКМО, значительно улучшает соотношения стоимость/эффективность и риск/выгода для пациента.
В клинике Legacy Emanuel Medical Center (Портленд, Орегон, США) в качестве такой стратегии был опробован метод перкуссионной вентиляции.

Результаты.
В клинике Legacy Emanuel Medical Center(LEMC) с октября 2009 по январь 2010 на ЭКМО находилось 15 пациентов с H1N1-пневмонией. 12 из них были взрослыми пациентами (от 26 до 59 лет), 7 удалось восстановить функцию легких и отлучить от ЭКМО, 6 выжили и были выписаны. 1 пациент скончался вследствие церебральной гипоксии, перенесенной до начала ЭКМО-терапии. Данные этих 7 пациентов сравнивались с данными H1N1-пациентов из регистра Организации экстракорпоральных методов жизнеобеспечения (ELSO), среди которых 135 восстановили респираторную функцию, 118 выжили и были выписаны.
До перевода на ЭКМО пациенты находились на механической вентиляции в течение 3,7 ± 1,6 дней, среднее значение соотношения PaO2/FiO2 равнялось 58,9 ± 5,5. Данные ELSO-пациентов по этим параметрам значимо не отличались. 7 пациентов клиники LEMC провели на ЭКМО 193,3 ± 35,7 часов, что значительно меньше, чем у ELSO-пациентов: 296,6 ± 18,2.
VDR – пневмоприводной вентилятор с ограничением давления, который поставляет пациенту порции воздуха субдыхательного объема со сверхвысокой частотой (высокочастотная перкуссионная вентиляция, ВЧПВ).Высокочастотный поток создается специальным интерфейсом – Фазитроном, который подает маленькие (около 30 см 3 ) перкуссионные толчки с частотой от 50 до 900 ударов в минуту.
ВЧПВ экспериментально использовалась на животных с аспирационными и ингаляционными травмами; в ходе этих исследований было зафиксировано улучшение оксигенации и выведения углекислого газа, наряду с заживлением повреждений легких и уменьшением воспаления. Клинические исследования, в которых участвовали пациенты с травмами и ожогами легких, показывают улучшение оксигенации, соотношения PaO2/FiO2, вентиляции и комплаенса по сравнению с традиционными методами механической вентиляции.
ВЧПВ улучшает оксигенацию, рекрутирует ателектатические очаги легких, мобилизует мокроту без вентилятор-ассоциированного повреждения легких. Специфика вентиляции аппаратом VDR позволяет увеличить среднее давление в дыхательных путях без повышения пикового давления на вдохе.
Пациенты клиники в среднем провели 8 дней на ЭКМО (от 3 до 15) с поддерживающей перкуссионной вентиляцией. Данные ЭКМО-пациентов без ВЧПВ из регистра ELSO: Италия – в среднем 9 дней (от 7 до 15), Япония – 9 дней (6,5–12,5), Австралия и Новая Зеландия – 10 дней (7–15), Канада – 15 дней (14–15), Швеция – 16 дней (9,5–30,5), Китай – 18 дней (2,8–90), Франция – 23 дня (3–47). Сложность случаев и небольшой объем выборки ограничивают валидность конкретных выводов, тем не менее, специалисты Legacy Emanuel Medical Center заявляют, что использование VDR у пациентов с H1N1-пневмонией позволяет сократить срок пребывания на аппарате ЭКМО. Это позволяет уменьшить затраты на лечение пациента и изменить соотношение риска/пользы в лучшую сторону. Для окончательного подтверждения этой гипотезы требуются дальнейшие протоколированные проспективные исследования.
Искусственная вентиляция легких (ИВЛ) относится к числу достаточно травматичных способов интенсивной терапии, при проведении которой возможно развитие различных осложнений.
Все осложнения, связанные с проведением ИВЛ можно условно разделить на две группы: ранние и поздние. Осложнения, входящие в первую группу, возникают в первые минуты и часы после начала ИВЛ, а для развития осложнений второй группы обычно необходимо несколько суток или даже недель.
Нарушения гемодинамики обычно развиваются сразу после интубации пациента и начала аппаратного дыхания. Особой предрасположенностью к ним отличаются пациенты с гиповолемией. Причиной расстройств гемодинамики после начала ИВЛ служит снижение венозного возврата к сердцу вследствие положительного давления в дыхательных путях во время искусственного вдоха, нарушение диастолического наполнения желудочков, а также остаточное действие препаратов, использовавшихся для интубации пациента. Невыраженные расстройства гемодинамики обычно не требуют серьезной коррекции; в других случаях пациенту может потребоваться проведение инфузионной терапии и назначение инотропной поддержки.
Баротравма может проявиться как в самом начале ИВЛ, так и в более позднем периоде. Предпосылками к ее развитию служат: исходное наличие у пациента легочной патологии в виде буллезной эмфиземы, пневмосклероза, деструктивной пневмонии, неправильная настройка параметров ИВЛ, использование агрессивных режимов у пациентов с сохраненной дыхательной активностью, автоциклирование респиратора и так далее. Это осложнение обычно проявляется развитием пневмоторакса, либо пневмомедиастинума или даже пневмоперикарда (значительно реже). Лечение последствий баротравмы заключается в коррекции режима и параметров вентиляции, а также устранению пневмоторакса (пневмомедиастинума). Более мягким вариантом баротравмы является развитие интерстициальной эмфиземы легких.
Ателектаз при проведении ИВЛ может иметь свой причиной как неправильное стояние эндотрахеальной (трахеостомической) трубки — ее расположение в одном из главных бронхов (чаще в правом), так и закупорку главного или долевых бронхов сгустками мокроты. Все это приводит к гиповентиляции или полному отсутствию вентиляции перекрытых отделов бронхолегочного дерева. Ателектаз проявляется ослаблением дыхания над пораженным участком, а также характерной рентгенологической картиной. Лечение ателектаза заключается в устранении его причины и дальнейшем продолжении ИВЛ.
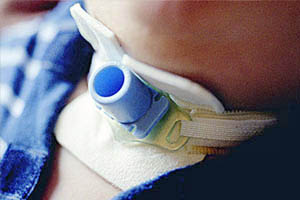
Обструкция эндотрахеальной (трахеостомической) трубки является достаточно частым поздним осложнением ИВЛ, которое очень опасно для пациента при его несвоевременном распознавании. Обструкция обычно происходит за счет высыхания мокроты на внутренней поверхности трубки, при этом наиболее опасен вариант обструкции по клапанному механизму, когда воздушная смесь поступает к пациенту во время вдоха, а выдох невозможен. Пациент ведет себя крайне беспокойно, жалуется на нехватку воздуха. Заподозрить обструкцию трубки можно при выполнении ее санации или при попытке вентилировать пациента при помощи мешка AMBU. Лечение состоит в немедленной переинтубации пациента, либо замене трахеостомической трубки.
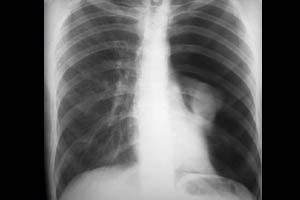
Стенозы трахеи также относятся к поздним осложнениям ИВЛ. Они проявляются после экстубации пациента. Клиническая картина зависит от уровня и степени стеноза, но обычно включает в себя затруднение дыхания и стридор различной степени выраженности. Все это может потребовать реинтубации пациента или наложения трахеостомы. Лечение стенозов обычно хирургическое.
Вентилятор-ассоциированная пневмония является поздним осложнением механической вентиляции легких. Она обычно развивается начиная с третьи суток пребывания пациента на ИВЛ. Как правило, вентилятор-ассоциированная пневмония вызывается внутрибольничной флорой реанимационного отделения, а отсюда плохо поддается стандартной антибактериальной терапии. Наиболее частые возбудители: клиебсиелла, ацинетобактер, золотистый стафилококк. Диагностика вентилятор-ассоциированной пневмонии проводится на основании клиники (стойкая лихорадка, аускультативная картина), лабораторных данных, рентгенологической картины. Обязателен посев мокроты и определение чувствительности выделенной культуры к антибиотикам. Лечение заключается в назначении эмпирической, а затем и прицельной антибактериальной терапии, обычно состоящей из антибиотиков резерва. Эффективно также назначение антибиотиков и антисептических средств ингаляционно.
Синуситы развиваются обычно вследствие длительной интубации трахеи, особенно назотрахеальной. Относятся к поздним осложнениям ИВЛ. Проявляются общевоспалительной реакцией, явная клиническая симптоматика может отсутствовать. Диагностируются обычно с помощью ренгтгенографии черепа и компьютерной томографии. Лечение заключается в назначении антибактериальных препаратов. При необходимости проводится хирургическая санация очага.
Инфицирование трахеостомы также относится к поздним осложнениям. Проявляется видимым инфицированием отверстия, в котором находится трахеостомическая трубка. Диагностика обычно не вызывает затруднений. Лечение заключается в назначении антибактериальных и антисептических средств на место инфекции. Системная антибактериальная терапия требуется редко.
Читайте также:

