Сколько молекул в чайнике
Обновлено: 05.07.2024
Наш мир живёт по законам, которые легко объяснимы благодаря законам химии и физики. О том, какой именно процесс произошёл с каким-то телом или веществом, можно судить по характеру изменений. А по каким признакам можно узнать, кипение воды – это физическое или химическое явление?
Характеристики явлений
Основным признаком всех физических явлений считается неизменность состава тел. Проще говоря, все вещества, которые участвовали в процессе, по его окончании сохраняют свой первоначальный состав. Изменяться может форма вещества или его агрегатное состояние. Например, состав воды остаётся одним и тем же, будь она в твёрдом, жидком либо парообразном состоянии. При понижении температуры вода может превратиться в лёд, а при повышении – снова перейти в жидкое состояние.
Во время химических реакций происходит превращение одних веществ в другие, и при этом приобретаются новые свойства.
Например, при сжигании бумаги, кроме золы, образуется некоторое количество влаги и углекислого газа. Причём получить бумагу обратно уже невозможно. Также сюда относится ржавление железа. Его реакция с кислородом, входящим в состав воздуха, ведёт к образованию оксида железа, который имеет совсем другие свойства, нежели первоначальный металл.
В отличие от физических явлений, химические протекают с изменением цвета, запаха, температуры, выделением различных газов. Каждое вещество имеет свой состав и обладает какими-то особенными свойствами. Одна из главных задач химии – изучение строения тел, а также особенностей их превращения во время реакций. Очень часто химические реакции осуществляются одновременно с физическими. Поэтому физические свойства тел зависят и от химических реакций, протекающих в них.
Что такое испарение
Процесс парообразования принято называть испарением. Объясняется оно таким образом. При ударах молекул друг о друга их скорость изменяется. Часто она увеличивается до такой степени, что превышает притяжение близлежащих молекул. Это позволяет молекуле, которая передвигается с большой скоростью, отрываться от поверхности. Следует сказать, что процесс парообразования является постоянным, независимо от температуры воздуха.
Молекулы, оторвавшиеся от поверхности, некоторое время находятся над ней в виде пара. Благодаря хаотичному движению определённое их количество может вернуться снова в воду. Поэтому на скорость испарения влияет ветер, который своей силой переносит пар в сторону. В закрытой ёмкости парообразование моментально прекращается, поскольку оторвавшиеся молекулы через определённое время снова попадают в воду.
Поскольку это явление не влияет на изменение состава, можно выразить сомнения относительно распространённого мнения, что испарение воды – это химический процесс. Скорость парообразования зависит также от следующих факторов:
- Если притяжение молекул в жидкости понижается, то интенсивность парообразования возрастает.
- С увеличением площади поверхности, занимаемой жидкостью, увеличивается и скорость испарения.
- Повышенная температура оказывает существенное влияние на скорость движения молекул, а, следовательно, и на интенсивность парообразования.
Что такое кипение
Очень интересно происходит также кипение воды. Какое это явление? Его суть заключается в интенсивном парообразовании, происходящем во время повышения температуры жидкости, появлении в ней пара в виде пузырьков, которые, всплывая на поверхность, разрываются. При кипении температура воды не меняется, и этот градус называют температурой кипения.
Поскольку никаких изменений в составе жидкости не происходит, подобное явление считается физическим. Во время парообразования молекулы, отделившиеся от воды, забирают определённое количество внутренней энергии. Это приводит к постепенному охлаждению жидкости.
опишите, пожалуйста, физику процесса. википедию про кристаллизацию уже читала. мои рассуждения: в воде растворены соли (т. е. молекулы кристаллов плавают среди молекул воды) . начинается кипение: на твердых частичках, растворенных в воде, и на стенках образуются пузырьки воздуха, внутрь пузырька начинается все более активное испарение, пузырек выталкивается наверх, там лопается, а твердые частички куда? обратно в воду плюхаются? в какой момент образуется накипь, во время кипения или при охлаждении воды? или так.. . кинетическая энергия молекул увеличивается, кристаллики сталкиваются и слипаются в более крупные (сейчас в чайнике возникнет планетная система :))..
Дядя Митя, а почему оседают, в какой момент? именно это и интересно! Их же так трудно потом отодрать от стенок, что за процесс "приклеивает" их в стенкам?
накипь образуется из солей жесткости это соли кальция и магния как правило карбонаты. . при нагревании карбонаты переходят в нерастворимую форму (химически превращаются) . поскольку горячо в основном только у стенки то все эти неравстворимые соединения образуются непосредственно на стенке, поскольку стенка шероховатая то в этих маленьких царапинках все и происходит, а делее происходит рост кристалла соли.
Соли при разных температурах имеют разные растворимости в воде, что связано с энергией их кристаллических решеток. Как правило, за небольшим исключением, растворимость солей в воде с повышением температуры повышается. Соответственно, при охлаждении растворимость солей в воде падает, энергия идет на формирование кристалла, поэтому растворенные в воде соли начинают выпадать в виде кристаллов на развитой поверхности. Кипение способствует увеличению концентрации растворенных солей, а значит, способствует и формированию пересыщенного раствора и выпадению кристалла. В целом, теория кристаллизации, да и вообще, теория растворов недостаточно проработана, хотя попытки были. Советую посмотреть на теорию Дебая-Онзагера или на теорию Дерягина-Ландау-Фервея-Овербека.
Всё проще некуда.
В воде растворены гидрокарбонаты кальция и магния.
При нагревании они превращаются в нерастворимые карбонаты и оседают на стенках.

Наливаете стакан сока и добавляете туда лед, моете стакан водой, а потом можно еще паром обдать, чтобы стакан был совсем чистым. В этом процессе трижды используется вода, но в разных агрегатных состояниях. Давайте разбираться, в каких.
О чем эта статья:
Статья находится на проверке у методистов Skysmart.
Если вы заметили ошибку, сообщите об этом в онлайн-чат (в правом нижнем углу экрана).
Агрегатные состояния вещества
Чтобы разобраться с тем, какими бывают агрегатные состояния, предлагаю по ходу чтения статьи заполнять таблицу.
Агрегатные состояния
Свойства
Расположение молекул
Расстояние между молекулами
Движение молекулы
Лед, вода и водяной пар — это все три агрегатных состояния одного вещества. Лед — твердое состояние, вода — жидкая, пар — газообразное. Для каждого вещества существует три состояния.
Твердое состояние
Его очень легко представить — это любой предмет, который мы встречаем в жизни. В этом состоянии тело сохраняет форму и объем. Расстояние между молекулами, приблизительно равно размеру самих молекул, которые, в свою очередь, расположены очень структурированно.
Такая структура называется кристаллической решеткой — из-за четкой структуры молекулам сложно двигаться, и они просто колеблются около своих положений.
Заполняем нашу табличку
Агрегатные состояния
Свойства
Расположение молекул
Расстояние между молекулами
Движение молекулы
сохраняет форму и объем
в кристаллической решетке
соотносится с размером молекул
колеблется около своего положения в кристаллической решетке
Жидкое состояние
В этом состоянии сохраняется объем, но не сохраняется форма. Например, если перелить молоко из кувшина в стакан, то молоко, имевшее форму кувшина, примет форму стакана. Кстати, в корове у молока тоже была другая форма.

Расстояние между молекулами в жидком состоянии чуть больше, чем в твердом, но все равно невелико. При этом частицы не собраны в кристаллическую решетку, а расположены хаотично. Молекулы почти не двигаются, но при нагревании жидкости делают это более охотно.
Вспомните, что происходит, если залить чайный пакетик холодной водой — он почти не заваривается. А вот если налить кипяточку — чай точно будет готов.
Агрегатные состояния
Свойства
Расположение молекул
Расстояние между молекулами
Движение молекулы
сохраняет форму и объем
в кристаллической решетке
соотносится с размером молекул
колеблется около своего положения в кристаллической решетке
близко друг к другу
малоподвижны, при нагревании скорость движения молекул увеличивается
Газообразное состояние
В жизни мы встречаем газообразное состояние вещества, когда чувствуем запахи. Запах очень легко распространяется, потому что газ не имеет ни формы, ни объема (он занимает весь предоставленный ему объем), состоит из хаотично движущихся молекул, расстояние между которыми больше, чем размеры молекул.
Агрегатные состояния
Свойства
Расположение молекул
Расстояние между молекулами
Движение молекулы
сохраняет форму и объем
в кристаллической решетке
соотносится с размером молекул
колеблется около своего положения в кристаллической решетке
близко друг к другу
малоподвижны, при нагревании скорость движения молекул увеличивается
занимают предоставленный объем
больше размеров молекул
хаотичное и непрерывное
На самом деле, есть еще четвертое — плазма. Звучит, как что-то из научной фантастики, но это просто ионизированный газ — газ, в котором помимо нейтральных частиц есть еще и заряженные. Ионизаторы воздуха как раз строятся на принципе перехода из газообразного вещества в плазму.
С агрегатными состояниями разобрались, ура! Но до сих пор неясно, каким образом у каждого вещества их целых три, и как одно переходит в другое. Для этого узнаем, что такое фазовые переходы.
Фазовые переходы: изменение агрегатных состояний вещества
При изменении внешних условий (например, если внутренняя энергия тела увеличивается или уменьшается в результате нагревания или охлаждения) могут происходить фазовые переходы — изменения агрегатных состояний вещества.
Фазовые переходы интересны тем, что все живое не Земле существует лишь благодаря тому, что вода умеет превращаться в лед или пар. С кристаллизацией, плавлением, парообразованием и конденсацией связаны многие процессы металлургии и микроэлектроники.
На схеме — названия всех фазовых переходов:

Переход из твердого состояния в жидкое — плавление;
Переход из жидкого состояния в твердое — кристаллизация;
Переход из газообразного состояния в жидкое — конденсация;
Переход из жидкого состояния в газообразное — парообразование;
Переход из твердого состояния в газообразное, минуя жидкое — сублимация;
Переход из газообразного состояния в твердое, минуя жидкое — десублимация.
График фазовых переходов
Если взять процесс превращения льда в воду, воды — в пар, и обратные действия, то мы получим очень информативный график.

Разбираемся по шагам. Сначала взяли лед, конечно, при отрицательной температуре, потому что при нуле лед начинает плавиться. Нагрели лед до температуры плавления (до 0 градусов).
После того, как лед нагрелся до температуры плавления, он начинает плавиться. Плавление происходит при постоянной температуре тем дольше длится, чем больше масса плавящегося вещества. Еще этот процесс зависит от свойств самого вещества, но об этом немного позже.
Расправившись вещество уже в жидком состоянии снова начинает нагреваться, и температура увеличивается, пока не достигает температуры кипения. В данном случае нагревается вода — это значит, что ее температура кипения равна 100 градусам Цельсия.
При 100 градусах вода кипит, пока не выкипит целиком. В данном случае процесс аналогично плавлению происходит при постоянной температуре. Данный процесс нельзя путать с испарением, потому что парообразование происходит при конкретной температуре, а испарение — при любой.
- DE — кипение (парообразование) воды
Далее полученный пар нагревается, но путем нагревания невозможно дойти до другого фазового перехода — можно пойти только обратно.
Первый шаг в обратную сторону — охлаждение до температуры кипения.
Дойдя до температуры кипения (в данном случае 100 градусов), пар начинает переходить в жидкое состояние. Этот процесс также происходит при постоянной температуре.
Сконденсировавшись, вода охлаждается, пока не начнет замерзать.
Кристаллизуется (замерзает) вода при той же температуре, что и плавится лед — 0 градусов. Кристаллизация также происходит при постоянной температуре.
После кристаллизации лед охлаждается.
С нагреванием и охлаждением все совсем просто — мы либо передаем теплоту телу (веществу), и оно идет на увеличение температуры, либо тело отдает тепло и охлаждается.
В остальных процессах температура не меняется. Это связано с тем, что количество теплоты не всегда зависит от температуры. Формулы для всех процессов выглядят так:
Нагревание
Охлаждение
Q — количество теплоты [Дж]
c — удельная теплоемкость вещества [Дж/кг*˚C]
m — масса [кг]
tконечная — конечная температура [˚C]
tначальная — начальная температура [˚C]
Плавление
Кристаллизация
Q — количество теплоты [Дж]
λ — удельная теплота плавления вещества [Дж/кг]
m — масса [кг]
Парообразование
Конденсация
Q — количество теплоты [Дж]
L — удельная теплота парообразования вещества [Дж/кг]
m — масса [кг]
Решение задач по фазовым переходам
С теорией разобрались — а теперь давайте практиковаться!
Задачка раз. Температура медного образца массой 100 г повысилась с 20 °С до 60 °С. Какое количество теплоты получил образец? Удельную теплоёмкость меди считать равной 380 Дж/(кг умножить на °С)
Сначала нужно перевести массу в килограммы:
Q = 380 * 0,1*(60-20) = 1520 Дж
Ответ: образец получил 1520 Дж
Задачка два. Какое количество теплоты необходимо для плавления 2,5 т стали, взятой при температуре плавления? Удельная теплота плавления стали λ=80кДж/кг. Теплопотерями пренебречь.
Сначала нужно перевести массу в килограммы и удельную теплоту в Дж/кг:
80 кДж/кг = 80000 Дж/кг
Q = 80000*2500 = 200 000 000 Дж = 200 МДж
Ответ: для плавления 2,5 т стали необходимо 200 МДж теплоты.
Сублимация и десублимация
Мы уже рассказали про такие процессы, как сублимация и десублимация.
- Переход из твердого состояния в газообразное, минуя жидкое — сублимация (возгонка);
- Переход из газообразного состояния в твердое, минуя жидкое — десублимация.
Примерчики из жизни🤓
Про белье. Попробуйте повесить белье сушиться на улицу в мороз. Поскольку вода замерзает из-за низких температур, белье должно вернуться домой в виде большого айсберга, но этого не происходит — оно возвращается абсолютно сухим. В данном процессе произошла возгонка молекул воды (сублимация).
Про принтеры. Цветные принтеры (только не лазерные) печатают путем сублимации. Вот как это работает: частицы краски быстро переходят из твердого состояния в газообразное и оседают на бумаге — так получается цветная картинка.
Рисуночки на окнах. Если вы решите проехаться на автобусе в холодную погоду — увидете на стеклах чудесные узоры. Из-за огромной разницы температур между улицей и автобусом, мы можем наблюдать процесс десублимации в виде красивых рисунков на стеклах. Иней образуется похожим способом — резкое похолодание приводит к десублимации воздуха.
Влажность воздуха: испарение и конденсация
Такие процессы, как испарение и конденсация, становятся более логичными и простыми, если их рассмотреть на примере влажности воздуха.
Влажность воздуха говорит нам о том, сколько в воздухе содержится водяного пара. Любое количество пара в воздух не запихнешь, поэтому, во-первых, его там очень мало, а во-вторых, при избыточном количестве водяного пара происходит конденсация — это когда образуется роса.
Допустим, зимой при температуре -20 градусов в 1 литре воздуха содержится 1 миллиграмм пара. Относительная влажность в таком случае равна 100% — испарения не будет, больше пара в этот воздух уже не запихнешь. Но если мы тот же воздух поместим в помещение с температурой +20 градусов, то в него может испариться уже до 17 миллиграмм пара. Значит, что его влажность будет равна 1/17 = 6%. Человеку комфортнее всего находиться при значении влажности 40-50%.
Как влажность влияет на человека
Для человека влажность очень важна, потому что мы состоим из воды на 90%. Если окружающей среде нечего испарять, она будет испарять нас. Поэтому при низкой влажности мы чувствуем сухость во рту, а при высокой — волосы впитывают влагу, разбухают и начинают виться. На этом принципе построены некоторые гигрометры — приборы для измерения влажности. Они так и называются — волосяные гигрометры. Только внутри не человеческий волос, а конский, но принцип от этого не меняется.
При высокой влажности холод и тепло воспринимаются более чувствительно. Это связано с потливостью человека при высокой температуре. Такой механизм помогает нам бороться с жарой, но при высокой влажности пот не может испариться. При испарении пота мы теряем избыточное тепло, а в данном случае этого не происходит.
При низкой влажности происходит нечто похожее. Как ни странно, в мороз мы тоже потеем (намного меньше, но все-таки это происходит). Если влажность на улице низкая, то пот испарится из-под куртки и нам будет комфортно, а при высокой влажности — он там задержится и будет проводить тепло наружу, забирая у нас драгоценные Джоули тепла. Поэтому зимой в Петербурге холоднее, чем в Москве.

Влажностью можно управлять. Существуют мешочки с шариками адсорбентами, которые кладут в коробки с обувью, чтобы впитать лишнюю влагу. Чтобы окна не запотевали, можно насыпать в рамы соль, которая также впитает влагу. А если вам наоборот нужно больше влаги — берем увлажнитель воздуха (классная вещь!): он добавляет в воздух водяной пар.
Человек на 80% состоит из воды. Она регулирует работу клеток и органов человеческого организма. Это основа жизни человека, которую он постоянно пополняет в организме. Можно ли без вреда водному составу кипятить ее несколько раз?
Возможно ли повторное кипячение в чайнике
Дистиллированная жидкость бесцветна, не имеет абсолютно никакого вкуса и запаха. Вода природная и из центрального водопровода имеет в своем составе примеси химических веществ, часть из них может навредить здоровью человека. В природной обитает микрофлора и микрофауна.

Сторонники здорового питания выступают против кипячения вообще. Они считают, что такая жидкость бесполезна. А вот врачи и приверженцы доказательной медицины уверены в необходимости тепловой обработки, для избавления от болезнетворных организмов. В потребительском плане кипячение – необходимость. Ведь способа заварить чай холодной водой еще не придумали.
Важно! Культура кипячения воды прочно обосновалась во всех семьях. А чайник, почти как самовар, стал центром кухни.
Возможно ли повторное кипячение и почему? Некоторая часть экспертов утверждает — нельзя.
Научные факты о повторных кипячениях
Испарение при закипании повышает концентрацию соли и других примесей в воде – вот главный довод о вреде кипячения повторно. В этом случае варение жидких блюд таких, как суп или компот, должны быть вовсе под запретом. Ведь в процессе приготовления жидкая составляющая испаряется, и блюда насыщаются солью и другими веществами. Сюда можно отнести любой кулинарный продукт, требующий варки.
Кипячение одной воды несколько раз утяжеляет жидкость. В ней появляется большое количество водородного изотопа — дейтерия. В действительности же, его настолько мало, что для концентрации его в опасных объемах нужно выкипятить цистерну жидкости.

Можно ли подливать свежую воду к уже кипевшей? Можно. Мнение, что в остатке накапливаются тяжелые соединения – ложно. Нагревание – это беспорядочное движение молекул. Навряд ли отдельные из них перемещаются только на дне.
Справка! Современные сооружения водной очистки не используют продукты на основе хлора. Для этого используется фильтрация и озонирование.
Если случилось так, что вода из водопровода действительно очищается хлором. Ее нужно просто отстоять в течение тридцати минут. За это время соединения хлора испарятся.
Сколько раз можно кипятить
Благоприятное влияние кипяченной воды на здоровье человека не зависит от количества ее кипячений.
Вода, которую прокипятили, улучшает кровообращение и пищеварение, очищает организм от токсинов.
Медики доказали, что достаточный объем выпитой жидкости снижает вес. А если выпивать утром на голодный желудок стакан воды, запускается обмен веществ организма. В теплом, не горячем, виде она используется в лечебных целях. Так, рекомендуется запивать лекарства.

Все перечисленные факты только подтверждают, что повторное доведение до кипения никак не влияет на водные свойства. Ее можно смело использовать для приготовления горячих напитков и утоления жажды.
Важно! Использование очистных фильтров и систематическое очищение накипи на чайнике только улучшит качество питьевой жидкости.
В итоге ученые пришли к выводу, что количество веществ, опасных для человека настолько мало, что не может никак навредить. Если очень сильно переживаете по этому поводу, прокипятите всего один раз.
Таким образом, устраняются все вредные микробы, а ненужные химические процессы не произойдут.
Размышления о количестве кипячений не стоят потраченного времени. Специалисты единогласно пришли к мнению, что изменения после нескольких нагреваний очень незначительны. Чтобы вода по-настоящему стала непригодна для употребления, ее нужно прокипятить более десяти раз. Если навязчивые мысли о вреде очень беспокоят просто кипятите ее один-единственный раз. Ведь это не составит никакого труда.
Какая лучше: кипяченная или сырая
Из написанного выше понятно, что воду можно спокойно доводить до кипения несколько раз. Однако предварительное очищение с использованием фильтров – не помешает. Сравним пользу кипяченной и сырой воды:
- Доказано, что сырая вода может быть опасна для человека. Она может влиять на развитие разных болезней. Рекомендуется использовать фильтры для кувшинов и предварительно отстаивать, для испарения газовых примесей.
- Прокипяченную жидкость все равно нужно отстаивать, чтобы оставшиеся тяжелые вещества осели на дно, а лишние газовые соединения испарились.
- Родниковая также не считается безопасной и полезной. Туда попадают химические нечистоты, человеческие и животные экскременты – это большая опасность. После утоления жажды такой жидкостью люди часто страдают расстройствами пищеварительного тракта.
Использование воды прокипяченной не один, а больше раз для питья и приготовления пищи абсолютно безопасно для человеческого организма. О ее плюсах и минусах можно спорить бесконечно. Ясно одно: в кипяченом виде она гораздо полезнее, чем родниковая или из-под крана.

Данный видеофрагмент дает объяснение нового понятия – количества вещества, единицы его измерения, а также знакомит с постоянной Авогадро и новыми формулами. При этом, на основе примеров, учащиеся видят, как находить количество вещества и число структурных единиц, что делает данную тему более доступной для понимания.

В данный момент вы не можете посмотреть или раздать видеоурок ученикам
Чтобы получить доступ к этому и другим видеоурокам комплекта, вам нужно добавить его в личный кабинет, приобрев в каталоге.
Получите невероятные возможности



Конспект урока "Количество вещества"
Следует различать массу и количество: 2 кг яблок – это масса, а 2 яблока – это количество. В жизни мы часто используем определённые порции, например, коробок спичек или мешок зерна, ведь никто из нас не будет поштучно покупать спички или зерно.

В химии для измерения количество вещества была выбрана единица, которая объединила в себе число частиц и массу. Эта единица называется моль и обозначается буквой n (эн). Чтобы измерить 1 моль любого вещества, нужно взять его столько грамм, какова относительная атомная или относительная молекулярная масса вещества.
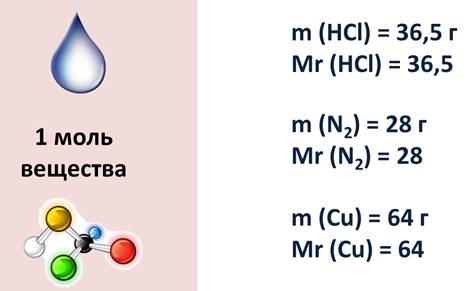
Давайте посмотрим на вещества количеством один моль: сравните, как отличается 1 моль воды, соли, кислоты и сахара. Почему? У этих веществ различная относительная молекулярная масса. У воды – 18, соли – 58,5, кислоты – 98, а сахара – 332, поэтому и масса вещества их тоже различна.

Например, 1 моль воды имеет массу 18 г, т.к. относительная молекулярная масса вода равна 18; 1 моль азота имеет массу 28 г, потому что относительная молекулярная масса его равна 28; 1 моль меди равен 64 г, т.к. относительная молекулярная масса ее равна 64.
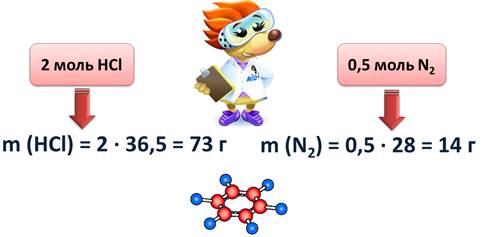
А если нам нужно узнать, какую массу имеет вода количеством 2 моль, то мы 2 умножим на 18, т.е. 36 г; 0,5 моль азота имеет массу 14 г, т.к. 0,5 умножить на 28, будет 14.
Количество вещества не только связано с массой, но и с числом частиц.
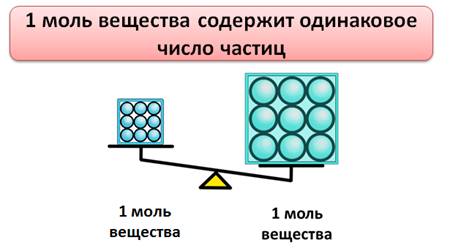
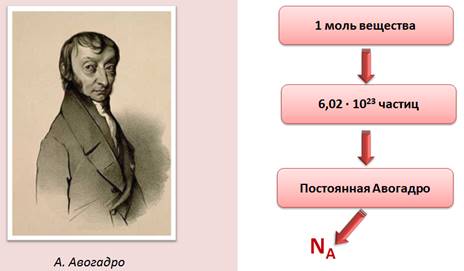
Установлено, что 1 моль любого вещества содержит одинаковое число частиц. Это число равно 6,02 · 10 23 . Это число называется постоянной Авогадро, в честь итальянского ученого А. Авогадро и обозначается оно NA.
Т.е. 1 моль воды имеет массу 18 г и содержит 6,02 · 10 23 частиц; 2 моль воды имеет массу 36 г и содержит 12,04 · 10 23 частиц; 0,5 моль азота имеет массу 14 г и содержит 3,01 · 10 23 частиц.

Для того чтобы узнать число частиц (N), которое содержится в определенном количестве вещества, можно использовать формулу:
N = NA · n
где n – количество вещества, т.е. число молей; N – число частиц.
Из этой формулы верны и следующие выражения:
NA = N/ n
n = N/ NA
Теперь дадим определение понятия моль – это такое количество вещества, в котором содержится 6,02 · 10 23 частиц этого вещества.
Используя новые формулы, решим задачи.
1. Определите количество вещества кислорода, в котором содержится 18,06 · 10 23 молекул.
Нам дано число молекул кислорода, найти нужноколичество вещества кислорода. Для решения этой задачи используем формулу n = N/ NA, подставляем значения в выражение и находим результат (величина NA является потоянной). Получается 3 моль. Следовательно, количество кислорода равно 3 моль.

2. Определите число молекул хлора (Cl2) которое, содержится в порции этого газа количеством вещества 0,1 моль.
В этой задаче по условию нам дано количество вещества хлора. Найти нужно число молекул. Следовательно, используем формулу N = NA · n, подставим данные в формулу, получаем результат 0,602 · 10 23 молекул. Получается, что порция хлора количеством 0,1 моль содержит 0,602 · 10 23 молекул.
Читайте также:

