Инертный осушитель как влияет на равновесие
Обновлено: 16.05.2024
План лекции:
Большинство химических реакций протекают одновременно в двух направлениях: в сторону образования продуктов реакции (прямая реакция) и в сторону разложения последних (обратная реакция). Вследствие химической обратимости реакции не доходят до конца. Скорость прямой реакции уменьшается, а скорость обратной, напротив, возрастает. Когда эти скорости выравниваются наступает состояние химического равновесия.
Так как химически обратимые реакции до перехода в равновесное состояние протекают с конечными скоростями, то с точки зрения термодинамики они не обратимы. Однако можно мысленно представить, что эти реакции идут бесконечно медленно через смежные равновесные состояния. Тогда к ним можно применить общие условия термодинамического равновесия.
Для гомогенных обратимых реакций экспериментально Гульбергом и Ваге был установлен закон действующих масс. При постоянной температуре отношение произведения равновесных концентраций (или парциальных давлений) продуктов реакции к произведению равновесных концентраций (или парциальных равновесий) исходных веществ есть величина постоянная.
Этот экспериментально установленный закон может быть получен методом термодинамических потенциалов. Рассмотрим реакцию в газовой фазе:
аА(г) + b В ↔ сС + dD
Когда система достигает термодинамического равновесия, то термодинамический потенциал при фиксированных естественных переменных достигает минимума. Равновесие, таким образом, можно охарактеризовать выражением химических потенциалов, когда потенциалы продуктов реакции сравняются с потенциалами исходных веществ:
с μ ( с ) + d μ (D) – a μ (a) - b μ (b) = 0 (6 – 1)
Если естественными переменными являются p и T , то = , а = V
Отсюда для систем, подчиняющихся закону идеальных газов, можно получить выражения для μ i
μ i = μ i ° + RTlnCi (6 – 2)
где μ i ° - стандартный химический потенциал.
Подставляется (6 – 2) в (6 – 1) и перенося постоянные величины в левую часть, получаем
сμ C ° + d μ D ° - a μ A ° - b μ B ° = - RTln (6 – 3)
Поскольку в левой части выражение не зависит от концентраций, то выражение под логарифмом является постоянной величиной при постоянной температуре:
Для идеального газа парциальные давления пропорциональны концентрациям, поэтому константа равновесия может быть всегда выражена через равновесные парциальные давления:
Аналогично может быть записано выражение через мольные доли:
Для идеальных газов эти константы связаны между собой соотношением:
Из уравнения (6 – 3) вытекает связь константы равновесия с ∆ rG °:
Это уравнение было впервые получено Вант – Гофором методом циклов и получило название уравнения изотермической химической реакции. Очевидно, в этом уравнении ∆ rGT ° относится к этой температуре, при которой определена Кр. Уравнение изотермической химической реакции позволяет определить константу равновесия при заданных условиях не прибегая к исследованию равновесия. Величина ∆ rGT ° может быть рассчитана на основе термических констант для индивидуальных веществ.
Если заданы концентрации (парциальные давления) отличные от равновесных, то можно записать более общий вид уравнения изотермической химической реакции:
Это выражение позволяет определить направление самопроизвольного процесса.
Уравнение изотермы химической реакции позволяет получить выражение для температурной зависимости константы равновесия.
Запишем уравнение Гиббса – Гельмгольца:
Подставим выражение для из (6 – 4)
Дифференцируем уравнение (6 – 5)
Из уравнения (6 - 5´) получаем уравнение изобары химической реакции:
Если проинтегрировать уравнение (6 – 6) в предположении, что ∆ rHT ° не зависит от температуры, то получим уравнение:
где С – константа интегрирования.
Уравнение (6 – 7) хорошо выполняется в узких интервалах температур и позволяет определить ∆ rGT °.
Для широких интервалов температур ln K р представляют в виде степенных рядов или других аналитических формах:
Такие выражения позволяют рассчитать все термодинамические функции для процессов, для которых данные зависимости получены.
Выражения для термодинамических потенциалов, полученные для идеального газа. Для реальных газов, а особенно для газовых растворов возникают затруднения. Это связано с тем, что расчет концентраций и давлений должен быть проведен исходя из уравнения состояния. Однако для реальных систем единое достаточно простое уравнение состояния получить не удалось.
В связи с этим в термодинамике реальных систем применяется эмпирический метод, предложенный Льюисом. Льюис предложил в уравнениях термодинамики, полученных для идеальных систем заменить давления p на величину летучести f , а концентрации С на активности a .
При такой замене выражения для констант равновесия не меняются по форме. Но этот прием позволяет связать экспериментально найденные свойства реального газа с термодинамическими параметрами.
Летучести и активности – это экспериментальные величины, которые находятся из условия, что для раствора при бесконечном разбавлении или газа при давлении стремящимся к 0 активность приближается к аналитической концентрации, а летучесть к реальному давлению идеального газа. Исходя из этой посылки рассчитываются активности и летучести.
При 1273 К и общем равновесии 30 атм. В равновесной системе
содержится 17% (по общему) . Сколько процентов будет содержаться в газе при общем давлении 20 атм.? При каком давлении в газе будет содержаться 25% ? (Газ считать идеальным).
В соответствии с законом Авогадро, объёмный процент равен мольному проценту. Следовательно, при 30 атм. будет равен:
В отличие от , для идеальных газов не зависит от давления. На основании этого находим при 20 атм.
При 2000°С и общем давлении 1 атм. 2% воды диссоцииовано на водород и кислород. Рассчитайте константу равновесия реакции при этих условиях.
Химическое равновесие — состояние химической системы, в котором обратимо протекает одна или несколько химических реакций, причём скорости в каждой паре прямая-обратная реакция равны между собой. Для системы, находящейся в химическом равновесии, концентрации реагентов, температура и другие параметры системы не изменяются со временем.
Мы как раз рассмотрим влияние на химическое равновесие трех факторов: концентрации, температуры и давления.
Еще в 1994 году французский химик Анри Луи Ле Шателье сформулировал общий принцип для смещения любого химического равновесия:
Если на систему, находящуюся в состоянии химического равновесия, оказывать внешнее воздействие (изменять температуру, давление, концентрации веществ), то положение равновесия смещается в такую сторону, чтобы ослабить внешнее воздействие.
Влияние концентрации на смещение химического равновесия
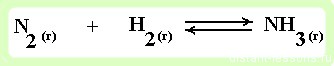
реакция образования аммиака — протекает в газовой среде
реакция образования сложного эфира — реакция, проходящая в жидкой среде.
- Увеличение концентрации реагентов смещает химическое равновесие в сторону продуктов реакции как в газовой, так и в жидкой среде.
- Удаление продуктов из среды реакции так же смещает равновесие в сторону продуктов реакции.
- Увеличение концентрации продуктов смещает химическое равновесие в сторону обратной реакции.
Влияние температуры на смещение химического равновесия
Все химические реакции делятся на два типа:

Соответственно, с помощью температурного воздействия мы можем оказывать влияние на смещение химического равновесия в системе:
в эндотермической реакции:
- увеличение температуры смещает равновесие в сторону продуктов (прямой реакции);
- уменьшение температуры смещает равновесие в сторону реагентов (обратной реакции);
в экзотермической реакции:
- увеличение температуры смещает равновесие в сторону реагентов (обратной реакции);
- уменьшение температуры смещает равновесие в сторону продуктов (прямой реакции);
Влияние давления на смещение химического равновесия
Этот вопрос относится только к реакциям в газовой среде .
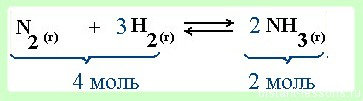
- При увеличении давления равновесие смещается в сторону меньшего объема (в данном примере 4 моль → 2 моль, т.е. равновесие сместится в сторону продукта реакции -образования аммиака).
- При уменьшении давления — в сторону большего объема (в сторону обратной реакции)
Если в реакции участвуют твердые вещества , например: 2C (тв) + O2 (г) ↔ 2CO (г), то их количество не учитывается .
Если объем (количество веществ) смеси не меняется , то изменение давления не будет оказывать влияние на смещение химического равновесия .
Катализаторы не влияют на смещение химического равновесия!
С целью наиболее полного использования сырья желательно вести технологический процесс в условиях получения наиболее высокой степени превращения исходного вещества. Поэтому большой практический интерес представляет установление влияния различных факторов на равновесие системы (т.е. равновесную степень превращения), а также разработка приемов, позволяющих сдвинуть равновесие в сторону образования целевых продуктов.
Основными параметрами, влияющими на равновесие химических реакций, являются температура, давление и концентрация реагирующих веществ. Эти параметры обычно используются на практике для сдвига равновесия в желаемую сторону, т.е. для регулирования равновесной степени превращения.
Влияние изменения внешних условий на положение равновесия – принцип Ле-Шателье: если на систему, находящуюся в устойчивом равновесии воздействовать извне, изменяя какое-либо из условий, определяющих положение равновесие, то в системе усилится то направление процесса, течение которого ослабляет влияние произведенного воздействия и положения равновесия сместится в том же направлении.
Рассмотрим обратимую реакцию:
Так как равновесие характеризуется равенством скоростей прямой и обратной реакции ( ), можно сказать, что смещение равновесия происходит тогда, когда произведенное воздействие неодинаково влияет на скорость прямого и обратного процессов. Это нарушение равенства скоростей и приводит к переходу системы в новое состояние равновесия, при которой снова, но будут отличаться от первоначальных значений.
Влияние давления
Влияние давления определяется знаком изменения объема ∆V (или знаком разности числа молей газообразных веществ): для реакций, протекающих с увеличением числа молей(∆n>0) увеличение давления не благоприятно. Смещению равновесия реакции вправо способствует снижение давления. Для реакций с уменьшением числа молей (∆n
На практике так и поступают – процесс ведут под давлением 32,0 МПа (320 кгс/см 2 ).
Для реакции (б), протекающей с увеличением объема, для смещения равновесия слева направо необходимо, наоборот, понижать давление. На равновесие реакции (в) изменение давления не влияет, т.к. объем системы в процессе реакции не изменяется.
Влияние инертного газа
Введение инертного газа в систему подобна эффекту уменьшения общего давления ( p ):
- если реакция протекает с уменьшением числа молей (∆n 0), равновесие смещается вправо.
Из закона Дальтона видно, что эффект разбавления подобен эффекту снижения общего давления в системе.
Влияние концентрации
В соответствии с принципом Ле- Шателье: введение избытка исходных веществ вызовет смещение в том направлении, чтобы уменьшить его концентрацию, т.е. вправо ; и введение избытка продукта сместит равновесие влево. Увеличивая концентрацию одного из реагентов (более дешевого), можно повысить степень превращения другого (дорогого).
Уменьшить концентрацию продуктов в зоне реакции можно за счет вывода реакционной массы из зоны реакции, отделение продуктов и возврата реагентов в зону реакции. Наиболее простым способом вывода продуктов из зоны реакции является их связывание химическим путем с другими, вводимыми извне веществами. Чаще используют способ, заключающийся в переводе всех или отдельных продуктов реакции в другое фазовое состояние и выводе их из системы. Этот процесс обычно осуществляют по циркуляционной схеме (циклической).
Смесь исходных реагентов А и В поступает в реактор, в котором происходит химическое взаимодействие между реагентами.
Рис – Циркуляционная схема химико-технологического процесса с выводом продукта реакции: 1 – реактор; 2 – конденсатор
На выходе из реактора в газовой смеси содержится продукт реакции и непрореагировавшие исходные реагенты А и В. Газовая смесь поступает в конденсатор 2, где она охлаждается. При этом продукт реакции R конденсируется и выводится из системы, А исходные реагенты А и В возвращаются в процесс.
Влияние температуры
Важное значение имеет тепловой эффект реакции
· повышение температуры процесса всегда благоприятствует накоплению веществ, образующихся в данной реакции с поглощением теплоты, т.е. усиливает эндотермическое направление процесса (∆Н > 0)

Видеофрагмент позволяет понять, что такое обратимость химических реакций и химическое равновесие. В уроке рассказано о способах смещения химического равновесия.
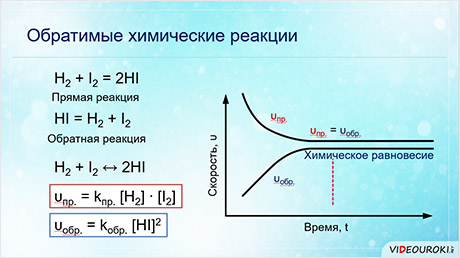
В данный момент вы не можете посмотреть или раздать видеоурок ученикам
Чтобы получить доступ к этому и другим видеоурокам комплекта, вам нужно добавить его в личный кабинет, приобрев в каталоге.
Получите невероятные возможности



Конспект урока "Обратимость химических реакций. Химическое равновесие"
Все химические реакции делятся на обратимые и необратимые. Необратимые реакции – это реакции, которые идут только в одном направлении. Необратимыми являются реакции горения (например, реакция горения метана), большинство реакций тэрмического разложения сложных веществ (например, реакция разложения перманганата калия), необратимыми являются большинство реакций, в результате которых образуется газ (например, реакция карбоната калия с серной кислотой), образуется осадок (например, в реакции соляной кислоты с нитратом серебра один), или если образуется малодиссоциирующее вещество (например, в реакции азотной кислоты и гидроксида натрия).
Обратимыми называются реакции, которые одновременно протекают в прямом и обратном направлении. В уравнениях обратимых реакций используют знак обратимости.
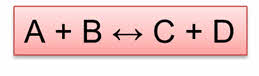
Реакция образования веществ Цэ и Дэ является прямой, а реакция образования А и Бэ является обратной.

Обратимыми являются также реакции этэрификации – это реакции взаимодействия карбоновых кислот со спиртами.
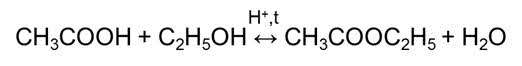
Одни и те же реакции при различных условиях могут быть обратимыми и необратимыми. Например, реакция разложения карбоната кальция. В открытой системе эта реакция является необратимой, так как углекислый газ выходит из зоны реакции, а в замкнутой системе эта реакция является обратимой, так как углекислый газ не уходит из зоны реакции.
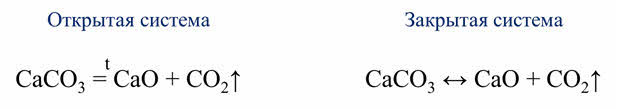
Обратимой является реакции синтеза йодоводорода из водорода и йода.
После некоторого времени после начала реакции в газовой смеси можно обнаружить не только йодоводород, но и исходные вещества – водород и йод. Если взять в качестве исходного вещества йодоводород, то через некоторое время также наряду с образовавшимися водородом и йодом в смеси будет содержаться йодоровород.
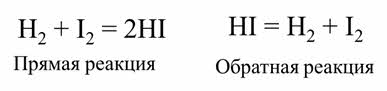
Если в качестве исходных веществ взять водород и йод, то скорость прямой реакции будет равна произведению концентраций водорода и йода.
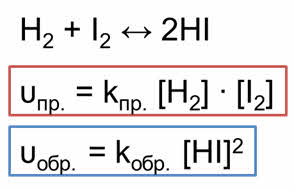
Скорость обратной реакции будет равна концентрации йодоводорода взятой в квадрате.
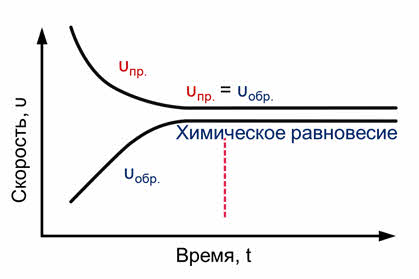
Постепенно скорость прямой реакции уменьшается, потому что водород и йод начинают реагировать и их концентрации уменьшаются.
Скорость же обратной реакции увеличивается, потому что концентрация образующегося йодоводорода увеличивается. Как только скорость прямой реакции окажется равной скорости обратной реакции, наступит химическое равновесие. Это равновесие считается динамическим, так как идут и прямая, и обратная реакции, скорости их также равны, а значит и концентрации веществ не изменяются. То есть их концентрации являются равновесными.
Если рассмотреть реакцию образования веществ Цэ и Дэ из А и Бэ, то скорость прямой реакции будет равна произведению равновесных концентраций А и Бэ с учётом их стехиометрических коэффициентов.
Скорость обратной реакции будет равна произведению равновесных концентраций Цэ и Дэ с учётом их стереохимических коэффициентов.
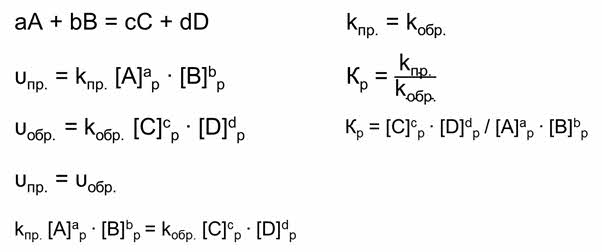
Так как в состоянии химического равновесия скорость прямой реакции равна скорости обратной реакции, то предыдущие выражения можно приравнять.
Константа скорости прямой и обратной реакции является величиной постоянной. А отношение констант скоростей прямой и обратной реакции является величиной постоянной, которая называется константой равновесия.
Константа равновесия зависит от температуры и давления, но не зависит от концентрации реагирующих веществ. Катализатор также не влияет на константу равновесия, но уменьшает время достижения равновесия.
Химическое равновесие является подвижным. То есть изменения внешних условий ведёт к смещению или сдвигу химического равновесия. Состояние же химического равновесия при неизменных внешних условиях может сохраняться бесконечно долго. Для многих химических производств состояние равновесия является нежелательным, так как не приводит к нужному выходу продукции. И поэтому для таких химических реакций нужно создавать условия, когда равновесие будет смещаться в нужную сторону.
Направление смещения равновесия определяется принципом, который сформулировал французский учёный Ле Шатэлье в 1884 году.

Согласно этому принципу, если на систему, находящуюся в состоянии химического равновесия, оказать внешнее воздействие, то равновесие смещается в сторону той реакции, которая противодействует этому воздействию.
На смещение химического равновесия влияют такие факторы, как концентрация реагирующих веществ, температура и давление.
Рассмотрим влияние концентрации на смещение химического равновесия. Как правило, при увеличении концентрации исходных веществ, равновесие смещается в сторону прямой реакции, при увеличении концентрации продуктов реакции равновесие смещается в сторону обратной реакции.
Так, в реакции получения оксида серы шесть из оксида серы четыре и кислорода, при увеличении концентрации оксида серы четыре равновесие смещается вправо, то есть в сторону прямой реакции.

Аналогично, при увеличении концентрации кислорода, равновесие смещается в сторону прямой реакции, то есть в сторону образования оксида серы шесть. При увеличении концентрации оксида серы шесть равновесие смещается в сторону обратной реакции, то есть влево.
Следовательно, при уменьшении концентрации оксида серы четыре и кислорода равновесие смещается влево, то есть в сторону обратной реакции, при уменьшении концентрации оксида серы шесть равновесие смещается в сторону образования оксида серы шесть, то есть в сторону прямой реакции.
Рассмотрим пример реакции взаимодействия хлорида железа три и роданида калия. В результате реакции образуется роданид железа три и хлорид калия. Эта реакция является обратимой. Если к хлориду железа три добавить роданид калия, то образуется раствор кроваво-красного цвета.
Разделим этот раствор на три равные части. В первую пробирку добавим роданид калия и раствор приобретает ещё более насыщенный кроваво-красный цвет, так как равновесие сместилось в сторону продуктов реакции. К третьей пробирки добавим твёрдый хлорид калия, раствор стал более светлым, то есть равновесие сместилось, в данном случае, в сторону исходных веществ.
Из этого опыта понятно, что при увеличении концентрации исходных веществ равновесие смещается в сторону продуктов реакции, а при увеличении концентрации продуктов реакции, равновесие смещается в сторону исходных веществ.
Рассмотрим, как влияет изменение температуры на смещение химического равновесия. Для начала большинства химических реакций необходимо нагреть исходные вещества, чтобы частицы получили необходимую энергию. Однако скорость прямой и обратной реакции зависит от того, являются ли эти реакции экзотэрмическими или эндотэрмическими.
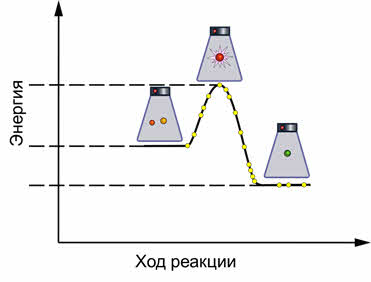
Как правило, увеличение температуры ведёт к увеличению скорости реакции. Для того, чтобы узнать как температура повлияет на смещение равновесия нужно знать тепловой эффект реакции. Так реакция превращения оксида азота четыре в его димер, является экзотэрмической.
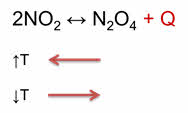
При увеличении температуры равновесие смещается в сторону эндотэрмической реакции, а при уменьшении температуры равновесие смещается в сторону экзотэрмической реакции.
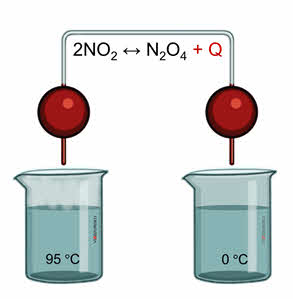
Для подтверждения этого проведём следующий эксперимент. В одну ёмкость нальём горячую воду, в другую – холодную. Опустим в две ёмкости колбы с бурым газом – оксидом азота четыре. Во второй колбе, которая опущена в холодную воду, газ бледнеет, так как оксид азота четыре переходит в его димер, который является бесцветным.
Как же влияет давление на смещение химического равновесия? Давление газов в системе при постоянной температуре определяется числом молекул газообразных веществ, или химическим количеством этих веществ. Поэтому для оценки влияния изменения давления необходимо подсчитать число молей газообразных веществ в левой и правой частях уравнения. При увеличении давления увеличивается концентрация газообразных веществ.
Например, в реакции синтеза аммиака из азота и водорода образуется 2 моль аммиака из исходных четырёх моль азота и водорода. Следовательно, было 4 объёма исходных веществ и образовалось 2 объёма аммиака. При увеличении давления объём уменьшается, поэтому идёт реакция образования аммиака. При уменьшении давления, объём увеличивается, что способствует реакции разложения аммиака на исходные вещества.
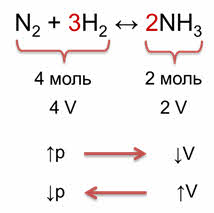
Таким образом, при увеличении давления равновесие смещается в сторону той реакции, при которой объём образующихся газообразных веществ уменьшается, и, наоборот, при уменьшении давления равновесие смещается в сторону той реакции, которая приводит к увеличению объёма. То есть, при увеличении давления равновесие смещается в сторону образования аммиака (вправо), а при уменьшении давления равновесие смещается в сторону исходных веществ (влево).
Катализаторы не влияют на смещение химического равновесия, так как они одинаково ускоряют как прямую, так и обратную реакцию. То есть катализаторы только ускоряют наступление химического равновесия. Например, дрова быстрее загораются, если их порубить (то есть увеличить площадь поверхности соприкосновения реагирующих веществ; на сильном огне быстрее закипит вода (потому то увеличивается температура), смазанные маслом детали автомобилей не ржавеют, так как не будет доступа кислорода.
Читайте также:

